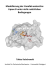
Praktikum: Physikalische Chemie - Moodle Rhein-Waal
Transcription
Praktikum: Physikalische Chemie - Moodle Rhein-Waal
Hochschule Rhein - Waal Praktikum: Physikalische Chemie Sommersemester 2015 gleichzeitig BETRIEBSANWEISUNG gem. § 14 GefStoffV Prof. Dr. Frank Platte, Nina Friedrich, Dr. Stefan Weber (überarbeitete Version) Version 2014 Prof. Dr. Peter F. W. Simon, Nina Friedrich, Dr. Stefan Weber, Dr. Conor Watson, Katharina Butwilowski 2 1 Inhaltsverzeichnis Arbeitsschutzmaßnahmen beim Umgang mit Gefahrstoffen – Laborordnung ............................ 3 Notrufnummern ............................................................................................................................ 9 Motivation / Ziel .......................................................................................................................... 10 Versuch 1: Gas-Gesetze ..................................................................................................................................................... 12 Versuch 2: Kinetik ..................................................................................................................................................... 16 Versuch 3: Thermodynamik von Mischphasen ..................................................................................................................................................... 23 Versuch 4: Kolligative Eigenschaften ..................................................................................................................................................... 28 Version 1.1 Motivation / Ziel 2 Arbeitsschutzmaßnahmen beim Umgang mit Gefahrstoffen - Laborordnung Praktikumsräume der Hochschule Rhein Waal Geltungsbereich (Institut/Räume): Praktikum für Chemische Analytik von Wirksubstanzen in Ernährung und Kosmetik Verantwortliche/r Hochschullehrer/in Prof. Dr. Peter F. W. Simon, 02821 – 80673 - 209 Gefahrstoffbeauftragte/r Dr. Weber, 02821 – 80673 – 204 Sicherheitsbeauftragte/r: Dr. Weber, 02821 – 80673 – 204 In Kraft gesetzt Datum, Unterschrift Diese allgemeine Laborordnung legt grundsätzliche Verhaltensweisen fest, gibt Hinweise auf besondere Gefährdungen und regelt den Umgang mit Gefahrstoffen. Sie ist verbindlich, muss allen Beschäftigten bekannt sein und leicht zugänglich aufbewahrt werden. Die Beschäftigten haben die einzelnen Vorgaben strikt zu beachten und einzuhalten. Stoffe, fest, flüssig oder gasförmig, einschließlich Mischungen und Lösungen (sog. Zubereitungen), gelten als gefährlich im Sinne der Verordnung über gefährliche Stoffe (Gefahrstoffverordnung – GefStoffV) sofern durch sie eine • Explosions- und/oder Brandgefahr • eine direkte oder indirekte Beeinträchtigung der Gesundheit des Menschen • eine Gefährdung der Umwelt bewirkt werden kann. Die Aufnahme von Stoffen in den menschlichen Körper kann durch Einatmen, durch Resorption durch die Haut oder die Schleimhäute, oder durch Verschlucken erfolgen. Wer mit solchen Stoffen umgeht, muss über ihre Eigenschaften, Wirkungen, zu treffende Schutzmaßen, Verhaltensweisen im Gefahrfall und mögliche Erste Hilfe-Maßnahmen unterrichtet sein. Er muss darüber hinaus wissen, wie eine sachgerechte Entsorgung zu erfolgen hat. Der Umgang mit Stoffen, deren Ungefährlichkeit nicht zweifelsfrei feststeht, hat so zu erfolgen wie der mit Gefahrstoffen. Gefahrstoffe können einer oder mehreren der nachfolgenden Eigenschaftsgruppen angehören. Sie müssen gekennzeichnet sein, für einen Teil von ihnen schreibt die Gefahrstoffverordnung darüber hinaus eine Kennzeichnung mit den unten aufgeführten Gefahrensymbolen vor. Das neue Einstufungs- und Kennzeichnungssystem für Chemikalien nach GHS verwendet Gefahrenpiktogramme. Bis 2015 können beide Kennzeichnungsarten nebeneinander vorkommen. Version 1.1 3 4 Motivation / Ziel Stoff- und Zubereitungsrichtlinie Gefahrenbezeichnung Kennbuchstabe Explosionsgefährlich E Hochentzündlich F+ Leichtentzündlich F Brandfördernd O keine Entsprechung GHS-Verordnung Symbol Bezeichnung Kodierung Explodierende Bombe GHS01 Flamme GHS02 Flamme über einem Kreis GHS03 Gasflasche GHS04 GHS05 Ätzend C Ätzwirkung Sehr giftig T+ Totenkopf mit gekreuzten Giftig T Gesundheitsschädlich Xn Reizend Xi GHS06 Knochen keine Entsprechung keine Entsprechung Ausrufezeichen GHS07 keine Entsprechung Gesundheitsgefahr GHS08 Umwelt GHS09 Umweltgefährlich N A. Grundregeln für den Umgang mit gefährlichen Stoffen Version 1.1 Piktogramm Motivation / Ziel A.1. Vor Aufnahme Ihrer Tätigkeit und danach in regelmäßigen Zeitabständen, jedoch mindestens einmal jährlich, müssen Sie mündlich und arbeitsplatzbezogen unterwiesen werden. A.2. Vor dem Umgang mit Gefahrstoffen sind durch den Anwender anhand von Betriebsanweisungen, Sicherheitsdatenblättern, Hersteller- oder Händlerkatalogen oder der Chemikalienliste des Labors die Gefahren, die von den Stoffen oder ihren Umwandlungsprodukten ausgehen, zu ermitteln. A.3. Die ermittelten besonderen Gefahren (R-Sätze/H-Sätze) und Sicherheitsratschläge (S-Sätze/PSätze) sind als Bestandteil dieser Betriebsanweisung verbindlich. A.4. Gefahrstoffe dürfen nicht in Behältnissen aufbewahrt oder gelagert werden, die zu Verwechslungen mit Lebensmitteln führen können (z.B. Bier- oder Sprudelflaschen). A.5. Brennbare Flüssigkeiten mit einem Flammpunkt unter 55° C dürfen an Arbeitsplätzen für den Handgebrauch nur in Behältnissen von höchstens 1 Liter Nennvolumen aufbewahrt werden. Ihre Anzahl ist auf das unbedingt nötige Maß zu beschränken. A.6. Sehr giftige und giftige Stoffe sind unter Verschluss zu halten. A.7. Kühl zu lagernde brennbare Flüssigkeiten sowie hochentzündliche und leichtentzündliche Stoffe dürfen nur in Kühlschränken oder Tiefkühleinrichtungen aufbewahrt werden, wenn deren Innenraum explosionsgeschützt ist (Elektrische Einrichtungen aus dem Innenraum entfernen). A.8. Sämtliche Standgefäße sind mit dem Namen des Stoffes und den Gefahrensymbolen/piktogrammen und -bezeichnungen zu kennzeichnen; größere Gefäße (ab 1 Liter) sind vollständig zu kennzeichnen, d.h. auch mit R- und S –Sätzen bzw. gemäß GHS mit H- und PSätzen. Wird in diesen Gefäßen auch gelagert, so sind diese wie folgt zu kennzeichnen: Substanzname(n), Gefahrensymbol(e)/-piktogramme, Gefahrenbezeichnung(en) R- und S-Sätze bzw. Gefahren- und Sicherheitshinweise/gemäß GHS - H- und P-Sätze, Hersteller. A.9. Das Einatmen von Dämpfen und Stäuben sowie der Kontakt von Gefahrstoffen mit Haut und Augen ist zu vermeiden. Beim offenen Umgang mit gasförmigen, staubförmigen oder solchen Gefahrstoffen, die einen hohen Dampfdruck besitzen, ist grundsätzlich im Abzug zu arbeiten (die üblichen Lösemittel). A.10. Das Essen, Trinken und Rauchen im Labor ist untersagt. Lebensmittel dürfen nicht im Labor oder zusammen mit Chemikalien in einem Kühlschrank aufbewahrt werden. Speisen und Getränke dürfen nicht im Trockenschrank oder anderen Laboröfen erwärmt werden. A.11. In Laboratorien ist das ständige Tragen einer Schutzbrille (Korrekturbrillen erfüllen im Allgemeinen nicht die Anforderungen die an Schutzbrillen gestellt werden. Ebenfalls geeignet ist ein Gesichtsschutzschirm), eines Laborkittels (i.d.R. ein Baumwoll-Laborkittel, dessen Gewebe aufgrund des Brenn- und Schmelzverhaltens keine erhöhte Gefährdung im Brandfall erwarten lässt) sowie festen, geschlossenen, trittsicheren Schuhwerks unbedingte Pflicht. A.12. Die in den Sicherheitsratschlägen (S-Sätzen) und speziellen Betriebsanweisungen vorgesehenen Körperschutzmittel wie z.B. Korbbrillen, Gesichtsschutz und geeignete Handschuhe sind zu benutzen. Beim Umgang mit sehr giftigen, giftigen oder ätzenden Druckgasen muss Atemschutz mit geeignetem Gasfilter am Arbeitsplatz bereitgehalten werden. A.13. Handschuhe dürfen außerhalb des Laboratoriums nicht getragen werden und sind beim Telefonieren, Öffnen von Türen aller Art, bei der Benutzung von Wasserhähnen etc. auszuziehen. Version 1.1 5 Motivation / Ziel A.14. Die folgenden Schriften sind zu lesen und ihr Inhalt ist bei Laborarbeiten zu beachten: Allgem. Vorschriften - GUV-V A1 – Richtlinien für Laboratorien - GUV-I 850 – Regeln für Sicherheit und Gesundheitsschutz beim Umgang mit Gefahrstoffen im Hochschulbereich - GUV-SR 2005 – Sicheres Arbeiten in chemischen Laboratorien GUV-I 8553 – stoffbezogene Gruppen- bzw. Einzelbetriebsanweisungen – relevante Unfallverhütungsvorschriften – Merkblatt für den Umgang mit krebserzeugenden und/oder erbgutverändernden Gefahrstoffen der Kategorien 1 und 2 A.15. Sind gem. Verordnung zur arbeitsmedizinischen Vorsorge Pflichtuntersuchungen erforderlich, so können Sie nur dann an Ihrem Arbeitsplatz weiterarbeiten, wenn Sie ärztlich untersucht worden sind und eine von einem ermächtigten Arzt ausgestellte Bescheinigung darüber vorliegt, dass gegen Ihre Beschäftigung keine gesundheitlichen Bedenken bestehen. A.16. Wenden Sie sich bei Unwohlsein aber auch bei den kleinsten Verletzungen sofort an einen Arzt (z.B. Personalarzt), auch wenn bereits Erste Hilfe geleistet worden ist. A.17. Jugendliche dürfen nur unter bestimmten Bedingungen und nur unter Aufsicht eines Fachkundigen mit explosionsgefährlichen, brandfördernden, hochentzündlichen, leicht entzündlichen und entzündlichen Gefahrstoffen umgehen. A.18. Beim Umgang mit sehr giftigen, giftigen, gesundheitsschädlichen, krebserzeugenden, ätzenden und reizenden Gefahrstoffen gelten für Jugendliche sowie werdende und stillende Mütter und gebärfähige Frauen in bestimmten Fällen Beschäftigungsbeschränkungen. – B. Allgemeine Schutz- und Sicherheitseinrichtungen B.1. Abzüge/ Digestorien sind keine Lagerorte für Gefahrstoffe! Stoffe und Geräte, die nicht unmittelbar für die Fortführung der Arbeit benötigt werden, sind aus dem Abzug zu entfernen. B.2. Die Frontschieber der Abzüge sind bei Betrieb geschlossen zu halten. Die Funktionsfähigkeit der Abzüge ist zu kontrollieren, z.B. durch einen Papierstreifen oder Wollfaden, (sofern keine elektronische Warnvorrichtung vorhanden ist). Defekte Abzüge dürfen nicht benutzt werden und sind entsprechend zu kennzeichnen. B.3. Jeder hat sich über den Standort und die Funktionsweise der Notabsperrvorrichtungen für Gas-, Strom- und Wasserversorgung zu informieren. Nach einer Notabschaltung ist unverzüglich der Laborleiter oder Aufsichtsführende zu informieren. B.4. Notduschen und Augenduschen sind durch das Laborpersonal monatlich auf ihre Funktionsfähigkeit hin zu prüfen. B.5. Feuerlöschmittel nie verdecken oder unzugänglich machen. B.6. Die schnelle und sichere Benutzbarkeit von Rettungswegen und Notausgängen muss immer gewährleistet sein. B.7. Feuerlöscher, Löschsandbehälter und Behälter für Aufsaugmaterial sind nach jeder Benutzung zu befüllen. B.8. Brandschutztüren sind geschlossen zu halten. Der Selbstschließmechanismus darf nicht blockiert werden. B.9. Becken-Siphons sind mit Wasser gefüllt zu halten, um die Abwasserleitungen gegen den im Labor herrschenden Unterdruck zu verschließen. Der Fußboden muss flüssigkeitsdicht und gegen die benutzten Gefahrstoffe hinreichend beständig sein. B.10. Der Inhalt der Erste-Hilfe-Kästen ist regelmäßig auf seine Vollständigkeit zu überprüfen und gegebenenfalls zu ergänzen. Version 1.1 6 Motivation / Ziel C. Abfallverminderung und -entsorgung C.1. Die Menge der Abfälle ist dadurch zu vermindern, dass nur die Mengen von Stoffen bei Versuchen eingesetzt werden, die unbedingt erforderlich sind. Reaktive Reststoffe, wie z.B. Alkalimetalle, Peroxide, Hydride sind sachgerecht zu weniger gefährlichen Stoffen umzusetzen. C.2. Chemische Abfälle sind in geschlossenen Behältern sammeln und nach Anweisung entsorgen. C.3. Ein Blick in die Liste der im Institut vorhandenen Chemikalien (Kataster) ersetzt eventuell einen Neukauf. D. Verhalten in Gefahrensituationen D.1. Beim Auftreten gefährlicher Situationen, z.B. Feuer, Austreten gasförmiger Stoffe, Auslaufen von gefährlichen Flüssigkeiten, sind die folgenden Anweisungen zu beachten: D.2. Ruhe bewahren und überstürztes, unüberlegtes Handeln vermeiden! D.3. Gefährdete Personen warnen, gegebenenfalls zum Verlassen der Räume auffordern. Grundsätze der Erste-Hilfe-Leistung beachten. D.4. Versuche sofort beenden, Gas, Strom und ggf. Wasser abstellen (Kühlwasser muss weiterlaufen!). D.5. Im Gefahrfall keine Aufzüge benutzen. D.6. Aufsichtsperson und/oder Laborleiter benachrichtigen. D.7. Bei Unfällen mit Gefahrstoffen, die Verletzungen auslösten oder die zu Unwohlsein oder Hautreaktionen geführt haben, ist ein Arzt aufzusuchen. Eine Unfallmeldung ist möglichst schnell, (binnen 3 Tagen) auf dem entsprechenden Formblatt zu erstellen und unterschieben an die Verwaltung weiterzuleiten. Version 1.1 7 Motivation / Ziel E. Grundsätze der richtigen Erste-Hilfe-Leistung PERSONENSCHUTZ GEHT VOR SACHSCHUTZ! E.1. Bei allen Hilfeleistungen auf die eigene Sicherheit achten! So schnell wie möglich einen notwendigen NOTRUF tätigen. E.2. Sofortige Rettung des Verletzten aus dem Gefahrenbereich - Eigengefährdung nicht unterschätzen (Einmalhandschuhe, Atemschutz). E.3. Löschen von Kleiderbränden durch Übergießen mit Wasser, Einwickeln in Decken oder durch Rollen der betroffenen Person am Boden. Kaltwasseranwendung (Eintauchen der Extremität in Eimer Wasser oder Übergießen von Wasser) bis zum Nachlassen der Schmerzen. Keimfreie Abdeckung der Brandwunden. E.4. Bei Kontamination mit Chemikalien: Kleidung entfernen. Haut abwaschen. Falls notwendig Notduschen benutzen. Unverletzte Haut mit Wasser und Seife reinigen, bei schlecht wasserlöslichen Substanzen, diese mit Polyethylenglykol (BASF oder Roticlean E der Fa. Roth) von der Haut abwaschen und mit Wasser nachspülen (kein Benzin oder Lösemittel benutzen). E.5. Bei Augenverätzungen mit weichem, umkippendem Wasserstrahl, d.h. mit der fest installierten Augendusche, das verletzte Auge von innen (Nase) nach außen bei gespreiztem Augenlid 10 Min. oder länger spülen. Augenklinik aufsuchen. E.6. Bewusstseinslage prüfen (Reaktion auf Ansprache/Berührung?), Atmung (Atembewegung, Atemstoß) und Kreislauf (Puls, Hautfarbe) prüfen und überwachen. E.7. Ist der Betroffene bei Bewusstsein ggf. durch Anheben der Beine in 20 - 30 Grad Position (Unterlegen von geeigneten Gegenstände) in Schocklage bringen. E.8. Bei Bewusstlosigkeit und ausreichender Spontanatmung in stabile Seitenlage bringen. Bei nicht vorhandener Atmung, Atemwege freimachen und freihalten (Ausräumen des MundRachenraumes - Kopf überstrecken) und Mund-zu-Mund oder Mund-zu-Nase Beatmung durchführen. E.9. Bei Atem- oder Kreislaufstillstand: Wiederbelebungsmaßnahmen ergreifen. Ersthelfer benachrichtigen. E.10. Rettungsdienst alarmieren. Verletzte Person bis zum Eintreffen des Rettungsdienstes nicht allein lassen. Rettungsdienst u.U. an der Haustür erwarten und zu dem Verletzten hinführen. E.11. Informationen für den Arzt bereitstellen (z.B. Angabe der Chemikalien, möglichst mit Hinweisen für den Arzt aus der GESTIS-Stoffdatenbank, Vergiftungsregistern u.a.). Erbrochenes und Chemikalien sicherstellen. Falls vorhanden, Merkblätter (z.B. Kühn-Birett oder Sicherheitsdatenblätter) der verursachenden Stoffe dem Arzt mitgeben. Version 1.1 8 Motivation / Ziel NOTRUFNUMMERN Feuer, Rettungsdienst, Unfall 112 Polizei 110 Giftnotruf Informationszentrale gegen Vergiftungen / Bonn 0228 / 287 - 32 11 Ärztlicher Notdienst (Tag und Nacht) Kleve 0180 5044110 Endziffer für Goch -15, Kalkar -30, Kleve -45 und -46 Uedem/Weeze -65 nächste Krankenhäuser: St.-Antonius-Hospital gGmbH Albersallee 5-7, 47533 Kleve Hilbertz Ulrich Dr.med. Hoffmannallee 66, 47533 Kleve Version 1.1 02821 / 490 0 02821 23820 9 Motivation / Ziel 3 Motivation / Ziel Im Rahmen dieses Praktikums sollen Sie in der Lage sein • die wichtigsten grundlegenden Theorien und Methoden der physikalischen Chemie mit Begriffen der physikalisch-chemischen Fachsprache zu beschreiben. • die Methoden der physikalischen Chemie experimentell umzusetzen. • erklären physikochemische Beobachtungen auf Basis grundlegender Theorien zu erklären. • Anwendungsfelder der physikalischen Chemie herauszustellen Umfang: 4 Praktikumstage a 150 min und Vortragsreihe Nummer Versuch 1 Gas-Gesetze 2 Kinetik 3 Thermodynamik von Mischphasen 4 Kolligative Eigenschaften Version 1.1 10 Protokollführung und Bewertung des Praktikums 4 Protokollführung und Bewertung des Praktikums 4.1 Anmerkungen zur Protokollführung und zur Bewertung Grundsätzlich muss sich aus der Versuchsvorschrift und dem Versuchsprotokoll das gesamte Experiment rekonstruieren lassen. Nur dann ist es möglich, verborgene Fehlerquellen aufzudecken und Verbesserungen zu finden. Um dieses Ziel zu erreichen, sollte das am Arbeitsplatz geführte Laborjournal folgende Angaben enthalten • Die Versuchsvorschrift in Stichworten, also die Schritte die Sie ausführen wollen unter Einbeziehung der zugrundeliegenden Theorie. • Das Versuchsprotokoll, das den tatsächlichen Verlauf des Experiments festhält -insbesondere die von Ihnen gemessenen Daten. Die Versuchsvorschrift und das Versuchsprotokoll kombinieren Sie zu einem Laborbericht und reichen diesen zur Bewertung ein. Dieser Bericht muss folgende Punkte enthalten, die in die Bewertung mit einfließen • • • • Kurzer Abriss der zugrundeliegenden Theorie [30 %] Darstellung der experimentell gemessenen Originaldatei einschließlich richtiger Darstellung der Einheiten [20 %] Nachvollziehbarkeit der Berechnungen in der Auswertung [30 %] Interpretation der ausgewerteten Daten mit Bezug auf die ursprüngliche Fragestellung [20 %] Jede Gruppe (i. d. R. fünf Studierende) reichen Laborberichte, die insgesamt bewertet werden. Fehlende oder abgeschriebene (kopierte) Berichte werden mit mangelhaft bewertet. In einer Vortragsreihe werden Individual-Noten vergeben, die mit 15 % in die Modulnote ein. Version 1.1 11 12 Gas-Gesetze 5 Gas-Gesetze 5.1 Lerninhalte 1. Allgemeine Zustandsgleichung für ein ideale Gas 2. Gay-Lussacs Gesetz (Charles Gesetz) 3. Gas Konstante 5.2 Aufgabe Untersuchen Sie den Zusammenhang zwischen Temperatur T und Druck p von Luft und bestimmen Sie die universelle Gaskonstante R experimentel! 5.3 Theorie Unterschiedliche Gase zeigen ein bemerkenswert ähnliches physikalisches Verhalten das nicht von ihrem chemischen Aufbaus beeinflusst wird. Im 17 Jahrhundert konnte durch eine Reihe von Experimenten nachgewiesen werden, dass die Eigenschaften eines Gases durch vier unterschiedliche Größen beschrieben werden kann: (i) Druck, p, (ii) Temperatur, T, (iii) Volumen, V, (iv) Stoffmenge, d. h. die Anzahl der Gasmoleküle in mol, n. Diese vier Zustandsgrößen beeinflussen sich gegenseitig; die Abhängigkeit des Drucks von der Temperatur, de, Volumen und der Stoffmenge muss daher durch das totale Differential dp = � ∂p ∂p ∂p � dT + � � dV + � � dn ∂T V,n ∂V T,n ∂n T,V ( 1) beschrieben werden. Im Falle einer vorgegebenen Stoffmenge bleibt die Anzahl, n, konstant und es gilt dn = 0. Wenn zusätzlich das Volumen nicht verändert wird (isochorische Bedingungen, d. h. V = konstant und damit dV = 0) vereinfacht sich Gleichung ( 1) zu dp = � ∂p � dT ∂T V,n ( 2) T ∂p � � dT ∂T V,n 0 ( 3) Wird der Druck in Abhängigkeit der Temperatur aufgetragen, kann das partielle Differential (∂p/∂T)V,n als die Steigung einer Tangente aufgefasst werden. Doch sei zuerst Gleichung ( 7) im Intervall von 0 bis p bzw. 0 bis T integriert. Die Lösung von p lautet � dp = � 0 ∂p p ∂p � oder =� � ∂T V,n T ∂T V,n Im Falle eines idealen Gas kann (∂p/∂T)V,n als konstant angesehen werden, also p = T� ( 4) p p1 p2 = = = konstant ( 5) T T1 T2 Entsprechend dieser Gleichung, die zuerst von Charles und Amontons beschrieben wurde, führt die Auftragung des Drucks, p, als Funktion der Temperatur, T, zu einer linearen Beziehung die im Ursprung p = T = 0 die Achsen schneidet. Version 1.1 13 Gas-Gesetze Die in Gleichung (5) eingeführte Konstante kann mit Hilfe des Gasgesetzes beschrieben werden. Einsetzen von p= in Gleichung ( 9) führt zu ∂�nRT�V� p =� � T ∂(T) V,n nRT V = nR ∂(T) nR � � = V ∂(T) V,n V ( 6) ( 7) Soll die Gaskonstante R experimentell bestimmt werden, so muss eine der drei Variablen (Druck, Volumen, Temperatur) konstant gehalten werden. In dem durchzuführenden Versuch wird bei konstantem Volumen gearbeitet. Umformung von Gleichung (6) ergibt nR ( 8) p= ∙T V und R kann bei bekannter Teilchenanzahl n aus der Steigung der Auftragung des Druckes p in Abhängigkeit der Temperatur T ermittelt werden. 5.4 Geräte: a. Cobra 3 Einheit b. Datenerfassungseinheit c. Computer mit Datenerfassungssoftware 5.5 Stoffe: 1. Destilliertes Wasser 2. Luft 5.6 Arbeitsanleitung: 1. Bauen Sie das Experiment nach Vorgabe auf. Beachten Sie hier insbesondere, dass sowohl der Spritzenkörper als auch die Verbindung zur Datenaufnahmeeinheit gasdicht sind. Um eine Leckage des Gases bei höherem Druck zu vermeiden, kann die Spritze mit einigen Tropfen Öl gefettet werden (transparenter Ölfilm im gesamten Bereich der Spritze). 2. Füllen Sie den Glasmantel mit Wasser – vergessen Sie den Rührfisch nicht! 3. Starten Sie nach Vorgabe des Betreuers das Datenerfassungsprogramm. 4. Überprüfen Sie, ob der Thermofühler eine sinnvolle Temperatur anzeigt (Raumtemperatur, ggf. Körpertemperatur). 5. Führen Sie den Thermofühler in den Glasmantel ein und fixieren Sie diesen in der Nähe des Spritzenkörpers. 6. Stellen Sie das Startvolumen der Spritze auf exakt 50 ml ein. 7. Starten Sie die Datenaufnahme Software. 8. Bestimmen Sie den Druck bei der Anfangstemperatur. 9. Erhöhen Sie die Temperatur durch Einschalten der Heizung um 5 K. Beachten Sie, dass hierbei das Wasser ständig durchmischt werden muss, um eine gleichmäßige Temperierung zu ermöglichen. 10. Sobald sich die neue Temperatur T eingestellt hat, drücken Sie den Kolben der Spritze rasch ein bis das ursprüngliche Volumen von V = 50 ml wieder erreicht wird und messen Sie den resultierende Druck p. 11. Wiederholen Sie die Schritte 9. und 10. bis die Maximaltemperatur von 370 K erreicht wurde. Die folgende Tabelle mag Ihnen helfen, die Daten zu organisieren: Version 1.1 14 Gas-Gesetze V = 50 mL T/K p / Pa 12. Wiederholen Sie die Messung für den Abkühlvorgang. 13. Tragen Sie die Daten aus der obigen Tabelle im Sinne der Gleichung ( 13) und bestimmen Sie die Steigung der Ausgleichsgerade. 14. Berechnen Sie aus der Ausgleichsgerade die Gaskonstante R. Zur Abschätzung der Teilchenanzahl n nehmen Sie an, Luft verhalte sich wie ein ideales Gas mit einem Molvolumen von VM = 22.414 molL-1. Version 1.1 15 Gas-Gesetze Gefahren für Mensch und Umwelt Die Spitze steht beim Verdichten unter Druck. Berstgefahr. Im Betrieb erwärmt sich der Heizmantel stark. Verbrennungsund Verbrühungsgefahr! Schutzmaßnahmen und Verhaltensregeln Bei Handhabung der Messapparatur sind Schutzbrille und ggf. Temperaturschutzhandschuhe zu tragen Verhalten im Gefahrfall Tropfmengen an verschütteten Flüssigkeiten mit geeignetem Adsorptionsmittel aufnehmen. Erste Hilfe Nach Hautkontakt: Mit viel Wasser abspülen. Nach Augenkontakt: Mindestens 15 Minuten bei geöffnetem Lidspalt mit Wasser spülen. Augenarzt! Nach Verbrennungen: Rasch kühlen (fließendes Wasser), keimfrei verbinden. Nach Verschlucken: Sofort - bei erhaltenem Bewusstsein reichlich Flüssigkeit (Wasser) trinken lassen. Mund ausspülen, Flüssigkeit wieder ausspucken, ggf. Aktivkohle geben Nach Kleidungskontakt: Kontaminierte Kleidung ausziehen. Notruf: 0-112; Entsorgung Genereller Laborabfall Version 1.1 16 Kinetik 6 Kinetik 6.1 Lernziele 1. 2. 3. 4. 6.2 Reaktionsgeschwindigkeit, Geschwindigkeitsgesetze, Arrheniusgleichung, Polarisation des Lichtes Aufgabe Bestimmen Sie die Aktivierungsenergie Ea der sauer katalysierten Inversion von Rohrzucker. Bestimmen Sie hierzu die Geschwindigkeitskonstante k bei drei unterschiedlichen Temperaturen T indem Sie die Reaktion durch die Änderung der optischen Drehung verfolgen. 6.3 Theorie Die säurekatalysierte Inversionsreaktion von Rohrzucker kann schematisch durch folgendes Schema skizziert werden Invertzucker Saccharose + H2O S + H2O Glucose + Fructose G + F ( 9) I Der eigentlichen Inversionsreaktion ist ein Gleichgewicht vorgelagert, dessen Gleichgewichtskonstante K wie folgt definiert ist S + H + ⇌ SH + ; 𝐾= [SH+ ] [H+ ]∙[𝑆] ( 10) Beachten Sie, dass im Folgenden die Konzentration der Einfachheit halber in eckigen Klammern (also […]) beschrieben werden wird! Das in Gleichung ( 10) formulierte Produkt SH+ reagiert in Gegenwart von Wasser weiter zu einem Gemisch aus Glucose G und Fructose F, welches auch als Invertzucker bezeichnet wird SH + + H2 O ⇌ G + F + H + ( 11) Die Reaktion findet im wässrigen Medium statt, daher ist die Konzentration an Wasser so groß, dass diese sich im Laufe der Reaktion nicht ändert. Bei der Aufstellung des Geschwindigkeitsgesetzes, kann diese daher mit in die Geschwindigkeitskonstante k' mit einbezogen werden. Unter Berücksichtigung von Gleichung ( 10) folgt daher für die Reaktionsgeschwindigkeit r 𝑟= d[G] = 𝑘" ∙ [SH + ] ∙ [H2 O] = 𝑘′ ∙ [SH + ] d𝑡 = 𝑘′ ∙ 𝐾 ∙ [H + ] ∙ [S] ( 12) Das Gleichgewicht ( 10) liegt im Wesentlichen auf der Seite der Edukte (K << 1), somit kann in guter Näherung für die Reaktionsgeschwindigkeiten angenommen werden Version 1.1 17 Kinetik d[G] d[F] d[S] ( 13) = =− d𝑡 d𝑡 d𝑡 Dies bedeutet nichts anderes als dass die Konzentrationen an Glucose und Fructose mit der gleichen Geschwindigkeit zunehmen, wie die der Saccharose abnimmt. 𝑟= Nehmen wir weiterhin am, dass die Konzentration der katalytisch wirkenden Protonen über die Reaktion konstant bleibt, so können wir unter Berücksichtigung von Gleichung ( 12) eine neue Geschwindigkeitskonstante k definieren 𝑘 = 𝑘′ ∙ 𝐾 ∙ [H + ] ( 14) Für die Reaktionsgeschwindigkeit gilt dann d[G] d[F] d[S] = =− = 𝑘 ∙ [S] d𝑡 d𝑡 d𝑡 Integration diese Differentialgleichung ergibt 𝑟= ln � [S]0 � = 𝑘(𝑡 − 𝑡0 ) [S] ( 15) ( 16) Hierbei ist [S]0 die Konzentration an Saccharose zum Zeitpunkt t0 (Beginn der Messung); beachten Sie, dass [S]0 geringer als die Einwaage-Konzentration [S]E sein wird, weil bis zum Beginn der Messung bereits ein Teil der Saccharose reagiert hat. Zur Verfolgung der Reaktion wird die optische Drehung ausgenutzt. Saccharose ist rechtsdrehend; die entstehende Glucose dreht ebenfalls nach rechts, während die Fructose dagegen stärker linksdrehend ist (Ein Lehrbuch der organischen Chemie mag bei der Klärung dieser Zusammenhänge hilfreich sein!). Insgesamt ändert sich während der Reaktion der Drehwinkel der optischen Drehung, der mit Hilfe eines Polarimeters bestimmt werden kann. Hierbei trifft das durch eine Linse gebündelte Licht einer Natriumdampflampe auf einen Polarisator. Der vom Polarisator (meist Nicolsches Prisma) durchgelassene Teil des Lichts ist linear polarisiert. Wird er durch ein weiteres Nicolsches Prisma (Analysator) betrachtet, dessen Schwingungsebene genau senkrecht zu der des Polarisators angeordnet ist, so bleibt das Gesichtsfeld dunkel; der Analysator lässt in dieser Stellung kein Licht durch. Sind Polarisator und Analysator dagegen parallel ausgerichtet, wird maximale Helligkeit beobachtet. Wird eine optische aktive Substanz in den Strahlengang zwischen den gekreuzten Nicols eingebracht, so wird das Gesichtsfeld wieder aufgehellt, da die Schwingungsebene des vom Polarisator durchgelassenen Lichts um den Winkel α gedreht wird. Soll wieder auf völlige Dunkelheit eingestellt werden, muss der Analysator um α nachgestellt werden. Dieser Drehwinkel kann auf einer Skala am Polarimeter abgelesen werden. Hierbei ist die Apparatur so aufgebaut, dass das Gesichtsfeld des Polarimeters in zwei Hälften geteilt ist und bei der aus gleiche Lichtintensität auf beiden Hälften eingestellt wird. Analog dem Lambert-Beerschen Gesetz hängt der Drehwinkel α bei gegebener Temperatur T und Wellenlänge λ von der Länge des Lichtweges d und der Konzentration des gelösten Stoffes […] ab. Version 1.1 18 Kinetik α = [𝛼] ∙ 𝑑 ∙ [⋯ ] ( 17) α = 𝑑 ∙ ([𝛼]S ∙ [S] + [𝛼]I ∙ [I]) ( 18) [I] = [S]E − [S] ( 19) α = 𝑑 ∙ �[𝛼]S ∙ [S] + [𝛼]I ∙ ([S]E − [S])� ( 20) α∞ = 𝑑 ∙ [𝛼]I ∙ [S]E ( 21) Mit der Einführung der Drehung [α] als Materialkonstante, wollen wir den Drehwinkel α beschreiben. Hierzu sollten wir uns nochmals vergegenwärtigen dass bei der Inversionsreaktion die Konzentration an Saccharose [S] ab- und die Konzentration an Invertzucker [I] zunimmt. Sei die Drehung [α]S und die des Invertzuckers [α]I so gilt zum Zeitpunkt t Da der Invertzucker aus der Saccharose entsteht, gilt für dessen Konzentration und damit für den Drehwinkel Am Ende der Reaktion t = ∞ ist die gesamte Saccharose in Invertzucker umgewandelt. Es gilt [S] = 0 und damit Um Gleichung ( 16) auswerten zu können, muss die Konzentration der Saccharose [S] mit dem messbaren optischen Drehwinkel verknüpft werden. Aus Gleichung ( 21) folgt α − α∞ = 𝑑 ∙ ([𝛼]S − [𝛼]I ) ∙ [S] α − α∞ [S] = 𝑑 ∙ ([𝛼]S − [𝛼]I ) ( 22) und für den Beginn der Messung zum Zeitpunkt t = 0 α0 − α∞ = 𝑑 ∙ ([𝛼]S − [𝛼]I ) ∙ [S]0 α0 − α∞ [S]0 = 𝑑 ∙ ([𝛼]S − [𝛼]I ) ( 23) Einsetzen von Gleichung ( 22) und ( 23) in Gleichung ( 16) führt zu ln � α0 − α∞ � = 𝑘 ∙ (𝑡 − 𝑡0 ) α − α∞ ( 24) Nach dieser Beziehung kann die Geschwindigkeitskonstante k aus der Bestimmung des Drehwinkels α ermittelt werden. Die Geschwindigkeit der Reaktion hängt stark von der Temperatur ab. Dieser Zusammenhang wird durch die sogenannte Arrheniusgleichung 𝑘 = 𝐴 ∙ 𝑒 −𝐸a ⁄𝑅𝑇 ( 25) beschrieben, welche den Zusammenhang zwischen Geschwindigkeitskonstante k, präexponentieller Faktor A, absoluter Temperatur T und der Aktivierungsenergie Ea beschreibt. Zur experimentellen Bestimmung der Aktivierungsenergie Ea wird für eine Reihe unterschiedlicher Temperaturen T die Geschwindigkeitskonstante k bestimmt und gemäß Version 1.1 19 Kinetik 𝐸a 1 ( 26) ∙ 𝑅 𝑇 deren natürlicher Logarithmus als Funktion der reziproken absoluten Temperatur aufgetragen. Hierbei ist Aktivierungsenergie Ea der Steigung proportional (mit der Gaskonstante R = 8,314 JK-1mol1 ); die Aktionskonstante A kann als der Abszissenabschnitt identifiziert werden. ln 𝑘 = ln 𝐴 − Version 1.1 20 Kinetik 6.4 Geräte: a. b. c. d. e. f. 6.5 Wasserbäder, vortemperiert auf 25, 30, 40 und 50 °C Messkolben, 25 mL Becherglas Pipetten und Peleusball Polarimeter Stoppuhr Stoffe: 1. Rohrzucker-Stammlösung, c0 = 0,5 molL-1 2. Salzsäure Stammlösung, c0 = 2,0 molL-1 3. deionisiertes Wasser 6.6 Arbeitsanleitung: 1. Temperieren Sie beide Lösungen und das Messrohr des Polarimeters auf 25 °C und warten Sie den Temperaturausgleich ab. 2. Entnehmen Sie jeweils ein Volumen von 25 mL der Rohrzucker und Salzsäurelösung in einem Becherglas miteinander. 3. Füllen Sie die Mischung blasenfrei in das Rohr des Polarimeters und bestimmen Sie die exakte Temperatur des Reaktionsgemisches 4. Bestimmen Sie die Temperatur des Reaktionsgemisches 5. Zum Zeitpunkt t = 0 wird die Stoppuhr und der Drehwinkel α0 bestimmt. Beachten Sie, dass die Schritte 2 bis 5 möglichst rasch hintereinander durchgeführt werden müssen. Zur Bestimmung des 6. Drehwinkels α gehen Sie wie folgt vor: 1. Stellen Sie mit dem Okulartubus das Gesichtsfeld scharf 2. Drehen Sie den Analysator bis beide Felder die gleiche Intensität aufweisen. Es gibt eine Stellung maximaler und eine minimaler Intensität – stellen Sie immer auf die der geringeren Intensität ein. 3. Nähern Sie sich diesem Winkel von beiden Seiten und lesen Sie den Nonius ab. 7. Wiederholen Sie die Bestimmung des Drehwinkels nach 1, 2, 4, 8 und 16. Hierbei muss der Zeitpunkt nicht sekundengenau eingehalten werden, vielmehr ist wichtig, dass Sie den exakten Zeitpunkt protokollieren. 8. Führen Sie die Schritte 1 bis 7 jeweils bei 30 °C und bei 40 °C aus. 9. Bestimmen Sie für jede der Reaktionstemperaturen α∞. 1. Füllen Sie die Reaktionslösung in einen 25 mL Messkolben 2. Erhitzen Sie die Reaktionslösung für 10 min auf 50 °C 3. Kühlen Sie die Reaktionslösung auf die gewünschte Temperatur ab und füllen Sie ggf. das verdampfte Wasser nach 4. Füllen Sie die Lösung in das Polarimeterrohr 5. Bestimmen Sie α∞ 10. Fassen Sie für jede Temperatur die Daten in einer Tabelle zusammen. Als Anhalt mag Ihnen diese Tabelle als Vorlage dienen. Gerne können Sie ein geeignetes Tabellenkalkulationsprogramm verwenden! Version 1.1 21 Kinetik θ = °C t / min t/s 0 0 α α-α∞ 𝛼0 − 𝛼∞ 𝛼 − 𝛼∞ 1 ln � 𝛼0 − 𝛼∞ � 𝛼 − 𝛼∞ 0 … ∞ ∞ 0 - - 11. Tragen Sie für jede Temperatur die Messdaten im Sinne von Gleichung ( 16) auf und ermitteln Sie die Geschwindigkeitskonstante k durch lineare Regression. 12. Tragen Sie ln k als Funktion der reziproken absoluten Temperatur T –1 im Sinne von Gleichung ( 21) auf. Als Anhalt mag Ihnen diese Tabelle als Vorlage dienen. Gerne können Sie ein geeignetes Tabellenkalkulationsprogramm verwenden! θ / °C T/K T –1 / K-1 k / s-1 ln (k / s-1) 13. Bestimmen Sie aus der Steigung der Ausgleichgeraden die Aktivierungsenergie Ea. und aus dem Achsenabschnitt die Aktionskonstante A. 6.7 Literatur: Försterling, H. D.; Kuhn, H. Praxis der Physikalischen Chemie: Grundlagen, Methoden, Experimente; Dritte, ergänzte Auflage, VCH: Weinheim, 1991; S. 156 Version 1.1 22 Kinetik Gefahren für Mensch und Umwelt Verdünnte Salzsäure ist reizend. Bei der Handhabung der vorgewärmten Lösungen besteht Verbrennungs- und Verbrühungsgefahr! Schutzmaßnahmen und Verhaltensregeln Bei Handhabung Der Lösungen sind Schutzbrille und ggf. Temperaturschutzhandschuhe zu tragen Verhalten im Gefahrfall Tropfmengen an verschütteten Flüssigkeiten mit geeignetem Adsorptionsmittel aufnehmen. Erste Hilfe Nach Hautkontakt: Mit viel Wasser abspülen. Nach Augenkontakt: Mindestens 15 Minuten bei geöffnetem Lidspalt mit Wasser spülen. Augenarzt! Nach Verbrennungen: Rasch kühlen (fließendes Wasser), keimfrei verbinden. Nach Verschlucken: Sofort - bei erhaltenem Bewusstsein reichlich Flüssigkeit (Wasser) trinken lassen. Mund ausspülen, Flüssigkeit wieder ausspucken, ggf. Aktivkohle geben Nach Kleidungskontakt: Kontaminierte Kleidung ausziehen. Notruf: 0-112; Entsorgung Genereller Laborabfall Version 1.1 23 Thermodynamik von Mischphasen 7 Thermodynamik von Mischphasen 7.1 Lernziele 1. 2. 3. 4. 7.2 Stoffmengenverhältnis, x Siedetemperatur, T Phasen- und Phasediagramme Dampfruck Ziel Erzeugen Sie das Siedediagramm des binären Systems Ethanol-Cyclohexan. Bestimmen Sie hierzu die Siedekurve experimentell durch Messung der Siedetemperatur und Berechnen Sie die Taukurve mit Hilfe der Gleichungen ( 3) bis ( 5). 7.3 Theorie Gegeben sei eine Mischung zweier mischbarer Flüssigkeiten "1" und "2". Die Siedetemperatur der reinen Komponente "1" sei höher als die von >Komponente "2", d. h. T1* > T2*. Beachten Sie, dass der Stern immer die Reinsubstanz bezeichnet! Der Dampfdruck der Mischung beider Flüssigkeiten, pTOTAL, kann über deas Raoult'sche Gesetzbeschrieben werden: 𝑝TOTAL = 𝑝1 + 𝑝2 = 𝑥1 𝑝1∗ + 𝑥2 𝑝2∗ ( 27) Hierbei bezeichnet xi das Stoffmengenverhältnis in Bezug auf Komponente i und p i* den Dampfruck der entsprechenden Reinsubstanz. Da die leichtflüchtige Komponente "2"zuerst verdampfen wird, unterscheidet sich die Zusammensetzung der Gasphase von der der Flüssigkeit. In der flüssigen Phase wird sich Komponente "1" anreichern, während in der Gasphase der Stoffmengenanteil von Komponente "2" zunehmen wird. Das Stoffmengenverhältnis in der Gasphase, y2, kann nach Dalton berechnet werden: 𝑦2 = 𝑝2 𝑝TOTAL = 𝑥2 𝑝2∗ 𝑝TOTAL ( 28) Beachten Sie, dass die Ergebnisse aus Gleichung ( 1) verwendet wurden, um den Partialdruck der Komponente "2" zu beschreiben. Schauen wir uns im nächsten Schritt die Siedetemperatur an. Eine Flüssigkeit (sowohl ein Reinstoff als auch ein Gemisch) siedet, falls ihr Dampfdruck dem Umgebungsdruck entspricht. Ein Siedediagramm stellt daher die Situation bei einem Druck von pTOTAL = 1 atm = 1.013·105 Pa = 760 Torr (Normaldruck) dar. Leider hängt der Dampfdruck noch von der Temperatur T ab, sodass wir nach dem ClaudiusClapeyron'schen Gesetz (integrierte Form) schreiben können 𝑝 ∗ (𝑇) = 𝑝 ∗∅ exp �− Version 1.1 ∆V 𝐻 1 1 � − �� 𝑅 𝑇 𝑇∅ ( 29) 24 Thermodynamik von Mischphasen In dieser Gleichung repräsentiert "ø" Standardbedingungen – aber beachten Sie, dass Gleichung ( 3) davon ausgeht, die Verdampfungsenthalpie, ΔVH, sei unabhängig von der Temperatur. Dies ist nicht ganz der Fall, sodass bei genauerer Betrachtung die empirische Antoine-Gleichung1 angewendet wird. Nun haben wir die gesamte Information, um x 2 and y2 im Temperaturbereich vonT1 bis T2 darzustellen. Die Zusammensetzung der flüssigen Phase folgt aus ( 1) mit pTOTAL = 1.013·105 Pa. 𝑥2 (𝑇) = 𝑝TOTAL − 𝑝1∗ (𝑇) 1.013 ∙ 105 Pa − 𝑝1∗ (𝑇) = 𝑝2∗ (𝑇) − 𝑝1∗ (𝑇) 𝑝2∗ (𝑇) − 𝑝1∗ (𝑇) ( 30) Hierbei sind die Dampfdrücke beider Reinstoffe p1* (T) and p2*(T) temperaturabhängig und müssen jeweils gemäß Gleichung ( 3) berechnet werden. Analog wird die Zusammensetzung der Gasphase durch Einsetzen von Gleichung ( 4) in Gleichung ( 2) berechnet: 𝑦2 (𝑇) = 𝑥2 ∙ 𝑝2∗ (𝑇) 1.013 ∙ 105 Pa ( 31) Ein berechnetes Phasendiagram für das binäre System Wasser / Aceton ist in Abbildung 1 wiedergegeben. Es zeigt die Siedetemperatur als Funktion des Stoffmengenanteils sowohl der gasförmigen als auch der flüssigen Phase (g and fl). Bei einer gegebenen Zusammensetzung der flüssigen Phase, xWASSER, kann aus Abbildung 1 sowohl die Siedetemperatur als auch die Zusammensetzung der Gasphase, yWASSER, ermittelt werden. Die blaue Kurve gibt hierbei die Zusammensetzung der flüssigen Phase wieder (Siedekurve), wobei die die rote Kurve die Zusammensetzung der Gasphase (Taukurve) beschreibt. Beachten Sie, dass für den Fall der reinen Substanzen (d. h. yWASSER = xWASSER = 0 und yWASSER = xWASSER = 1) sich beide Kurven treffen. Lassen Sie uns das nebenstehende Diagramm interpretieren für den Fall, dass in der Flüssigkeit das Wasser mit einem Stoffmengenanteil von xWASSER = 0.7 vorliegt. Starten Sie an diesem Punkt auf der Abszisse Abbildung 1: Siedediagramm eines idealen binären bis Sie die Siedekurve erreicht haben (blauer Pfeil). Von hier aus ziehen Sie eine horizontale Gemischs aus Aceton und Wasser Linie (schwarzer Pfeil), bis Sie auf die Taukurve treffen. Die Zusammensetzung der Gasphase wird als Abszissenwert abgelesen (roter Pfeil) – wie vermutet ist der Gehalt von Wasser in der Gasphase geringer und eine Anreicherung mit Aceton hat stattgefunden. 1 vgl. National Institute of Standards and Technology: ChemistryWebBook für weitere Informationen und eine Vielzahl nützlicher Konstanten (http://webbook.nist.gov) Version 1.1 25 Thermodynamik von Mischphasen 7.4 Geräte: a) b) c) d) e) f) g) h) 7.5 3-Halskolben Rückflusskühler 50 mL Tropftrichter Schliffthermometer 100 mL Messkolben Heizpilz Trichter Kristallisierschale Stoffe: i) Ethanol, j) Cyclohexan k) Siedesteine 7.6 Abbildung 2: Aufbau zur Bestimmung des Siedediagramms einer binären Mischung Durchführung 1. Bauen Sie die Apparatur gem. Abbildung 2 auf. Stellen Sie sicher, dass a. die Apparatur spannungsfrei aufgebaut ist b. die Schliffe entweder gefettet oder mit Teflon-Hülsen versehen sind c. der Heizpilz jederzeit entfernt werden kann d. der Rückflusskühler nicht verstopft ist e. die Kühlwasserzufuhr eingeschaltet ist f. der Heizpilz frei von Tropfmengen an Lösungsmittel ist 2. Beschicken Sie den Dreihalskolben mit 40 mL Ethanol und Siedesteinen. 3. Befüllen Sie den Tropftrichter mit 40 mL Cyclohexan 4. Schalten Sie den Heizpilz ein und bestimmen Sie die Siedetemperatur des reinen Ethanols nach 3 min leichten Sieden. 5. Schalten Sie den Heizpilz ab und lassen Sie die Flüssigkeit ein wenig abkühlen. 6. Geben Sie mit Hilfe des Tropftrichters 4 mL an Cyclohexan zu. 7. Schalten Sie den Heizpilz ein und bestimmen Sie die Siedetemperatur des Gemischs nach 3 min leichten Sieden. 8. Wiederholen Sie die Schritte 5. bis 7. zwei Mal 9. Wiederholen Sie die Schritte 5. bis 7. drei Mal, unter Zugabe von jeweils 8 mL an Cyclohexan 10. Beschicken Sie den Dreihalskolben mit 40 mL Cyclohexan und Siedesteinen. 11. Befüllen Sie den Tropftrichter mit 40 mL Ethanol 12. Schalten Sie den Heizpilz ein und bestimmen Sie die Siedetemperatur des reinen Cyclohexans nach 3 min leichten Sieden. 13. Schalten Sie den Heizpilz ab und lassen Sie die Flüssigkeit ein wenig abkühlen. 14. Geben Sie mit Hilfe des Tropftrichters 4 mL an Ethanol zu. 15. Schalten Sie den Heizpilz ein und bestimmen Sie die Siedetemperatur des Gemischs nach 3 min leichten Sieden. 16. Wiederholen Sie die Schritte 5. bis 7. zwei Mal 17. Wiederholen Sie die Schritte 5. bis 7. drei Mal, unter Zugabe von jeweils 8 mL an Ethanol 18. Fassen Sie die experimentellen Daten wie folgt zusammen Version 1.1 26 Thermodynamik von Mischphasen V(Cyclohexan) / mL 40 V(Ethanol ) / mL m(Cyclohexan) / g m(Ethano l) / g N(Cyclohexan) / mol N(Ethanol ) / mol xCYCLO HEXAN Θ(Siede) Θ /°C 0 1 81 40 0 78 … 0 In grau unterlegte Felder müssen Sie die experimentellen Daten eintragen, die übrigen Felder sind zu berechnen. Ihre Tabelle enthält natürlich mehr Zeilen als diese Vorgabe! Gerne können Sie hierbei ein Tabellenkalkulationsprogramm verwenden. Zur Berechnung der Masse, m, und der Anzahl, N, an Cyclohexan, bzw. Ethanol benötigen Sie jeweils deren Dichte, bzw. molare Masse (geeignete Tabellenwerke konsultieren und die verwendeten Größen im Protokoll vermerken!). 19. Erstellen Sie basierend auf den beiden letzten Spalten der obigen Tabelle die Siedekurve des Systems Cyclohexan / Ethanol in einem Diagramm T = f (xCYCLOHEXAN) Version 1.1 27 Thermodynamik von Mischphasen Gefahren für Mensch und Umwelt Cyclohexan und Ethanol sind brennbar, die Dämpfe führen in hohen Konzentrationen beim Einatmen zur Benommenheit. Beim Berühren des Heizpilz besteht und den heißen Oberflächen der Glasgeräte besteht Verbrennungsgefahr. Schutzmaßnahmen und Verhaltensregeln Arbeiten mit Cyclohexan und Ethanol nur im Abzug. Dämpfe nicht einatmen. Berührung mit den Augen und der Haut vermeiden Schutzbrille tragen. Verhalten im Gefahrfall Beim Verschütten kleiner Mengen mit Vermiculite aufnehmen bei größeren Mengen zusätzlich Umgebung warnen, ggf. Labor evakuieren. Erste Hilfe Nach Hautkontakt: Rasch mit viel Wasser abspülen, bei größeren Verätzungen Arzt! Nach Augenkontakt: Mindestens 15 Minuten bei geöffnetem Lidspalt mit Wasser spülen. Augenarzt! Nach Einatmen: An die frische Luft bringen Nach Verschlucken: Rasch möglichst viel Wasser trinken, ggf. Aktivkohle geben; kein Erbrechen auslösen. Notarzt! Bei Verbrennungen: Intensiv Kühlen, Keimfrei abdecken und Arzt aufsuchen, bei großflächigen Verbrennungen Notarzt! Nach Kleidungskontakt: Kontaminierte Kleidung sofort ausziehen. Notruf: 0-112; Entsorgung Cyclohexan, Ethanol und damit kontaminierte wässrige Abfälle: organische Abfälle Version 1.1 Kolligative Eigenschaften 28 8 Kolligative Eigenschaften 8.1 Lernziele: 1. Kolligative Eigenschaften 2. Siedepunktserhöhung 3. ebullioskopische Konstante 8.2 Aufgabe Bestimmen Sie die ebullioskopische Konstante kEb von Wasser durch Messung der Siedepunktserhöhung. 8.3 Theoretischer Hintergrund Manche Eigenschaften von Lösungen erweisen sich als unabhängig von der Art der gelösten Teilchen. Hierzu zählen Phänomene wie der osmotische Druck, die Siedepunktserhöhung oder die Gefrierpunktserniedrigung. Man spricht von kolligativen Eigenschaften (lat. colligere bedeutet sammeln und bringt zum Ausdruck, dass es nicht auf die Art, sondern nur auf die Menge der gelösten Teilchen ankommt.). Im Praktikumsversuch soll die Siedepunktserhöhung näher untersucht werden. Löst man eine Substanz in einem Lösungsmittel, so erhöht sich dessen Siedepunkt. Für die Erhöhung ΔTS der Siedetemperatur gilt: Δ𝑇𝑆 = 𝐾𝐸𝑏 ∙ 𝑚𝑔 , ( 32) wobei KEb die ebullioskopische Konstante des Lösungsmittels und mg die Molalität (Einheit mol/kg) der gelösten Substanz ist. Beachten Sie, dass die Molalität das Verhältnis der Stoffmenge, n, zur Masse des Lösungsmittels (nicht Volumen(!) wie in der Molarität) darstellt und daher nur für verdünnte wässrige Lösungen der Konzentration gleichzusetzen ist. Sind mehrere Arten von Teilchen in der Lösung vorhanden, so bezieht sich mg auf die Gesamtstoffmenge aller in der Lösung vorhandenen Teilchen. In wässriger Lösung dissoziieren Salze, beispielsweise entsteht in unserem Falle aus einem mol NaCl jeweils ein Mol Na + und ein Mol Cl─ Ionen, sodass in Gleichung ( 10) insgesamt zwei Mol an Teilchen berücksichtigt werden müssen. Diese Abweichung wirden durch den van't-Hoff'schen Faktor, i, korrigiert und in Gleichung ( 10) wird zu: Δ𝑇𝑆 = 𝑖 ∙ 𝐾𝐸𝑏 ∙ 𝑚𝑔 Version 1.1 ( 33) 29 8.4 Stoffe: 1. Kochsalz, NaCl 2. deionisiertes Wasser 8.5 Geräte: 1. 2. 3. 4. 5. 6. 7. 8. 8.6 100 ml Dreihalskolben Rückflußkühler Schliffthermometer 100 ml Meßzylinder Heizhaube Trichter (groß) Messzylinder Waage Durchführung 1. Bauen Sie die Apparatur gemäß der Abbildung auf. Stellen Sie hierbei sicher, dass alles Schliffe entweder gefettet oder mit Teflonhülsen versehen sind und dass die Apparatur frei von mechanischen Spannungen aufgebaut ist. 2. Füllen Sie die Apparatur mit deionisiertem Wasser. Hierbei muss das Thermometer etwa 1 cm tief in die Flüssigkeit eintauchen. 3. Nach Öffnen des Kühlwasserflusses schalten Sie den Heilzpilz ein und erhitzen Sie die Lösung wird zum Sieden. Bestimmen Sie die Siedetemperatur TS nach ca. 3 Minuten kräftigen Siedens. 4. Entfernen Sie den Heizpilz mit Hilfe des Laborboys und lassen Sie die Lösung abkühlen. 5. Spülen Sie den Kolben sorgfältig. 6. Wiederholen Sie die Schritte 2 bis 5 mit 2,5 molaler Natriumchloridlösung. 7. Wiederholen Sie die Schritte 2 bis 5 mit 5 molaler Natriumchloridlösung. 8. Fassen Sie die Messdaten zusammen. Die folgende Tabelle mag Ihnen als Anhalt dienen: mg / mol·kg-1 0 TS / K ΔTS / K 0 2,5 5 9. Tragen Sie die Messdaten im Sinne von Gleichung ( 33) auf und bestimmen Sie aus der Steigung die ebuloskopische Konstante von Wasser. Verwenden Sie hierzu einen van'tHoff'schen Faktor von i = 1,8 . Version 1.1 30 Gefahren für Mensch und Umwelt Bei der Handhabung der Lösungen besteht Verbrennungsund Verbrühungsgefahr! Schutzmaßnahmen und Verhaltensregeln Bei Handhabung Der Lösungen sind Schutzbrille und ggf. Temperaturschutzhandschuhe zu tragen Verhalten im Gefahrfall Tropfmengen an verschütteten Flüssigkeiten mit geeignetem Adsorptionsmittel aufnehmen. Erste Hilfe Nach Hautkontakt: Mit viel Wasser abspülen. Nach Augenkontakt: Mindestens 15 Minuten bei geöffnetem Lidspalt mit Wasser spülen. Augenarzt! Nach Verbrennungen: Rasch kühlen (fließendes Wasser), keimfrei verbinden. Nach Verschlucken: Sofort - bei erhaltenem Bewusstsein reichlich Flüssigkeit (Wasser) trinken lassen. Mund ausspülen, Flüssigkeit wieder ausspucken, ggf. Aktivkohle geben Nach Kleidungskontakt: Kontaminierte Kleidung ausziehen. Notruf: 0-112; Entsorgung Genereller Laborabfall Version 1.1