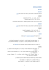הנוסחה שם שארית החומצה הנוסחה שם החומצה
Transcription
הנוסחה שם שארית החומצה הנוסחה שם החומצה
חומצות בסיסים על קצה המזלג2011/ חומצות ובסיסים מוגדרים בכמה צורות: הגדרת חומצה :ההגדרה הראשונה והמצומצמת ביותר היא זו של ארהניוס: חומצה היא כל חומר ,שמשחרר במים את היון ) , H3O+1(aqיון ההידרוניום .למעשה החומצה משחררת H+1אך ליון כזה אין קיום במים והוא מתלבש על מולקולה של מים. + ע"פ הגדרת ברונסטד ולאורי ) ,)Brønsted and Lowryחומצות הן תרכובות המסוגלות למסור יוני .H חומצות מורכבות מאל -מתכות בלבד. דוגמה :1חומצת מלח .HClהחומצה מסוגלת למסור יון אחד של ,H+ואז מתקבלת שארית החומצה ,יון הכלור .Cl- דוגמה :2חומצה גפרתית .H2SO4החומצה מסוגלת למסור שני יוני ,H+ואז מתקבלת שארית החומצה ,היון הגפרתי .SO4-2 דוגמה :3חומצה זרחתית .H3PO4החומצה מסוגלת למסור שלושה יוני ,H+ואז מתקבלת שארית החומצה ,היון הזרחתי .PO4-3 חומצות מגיבות עם מים לקבלת יון הידרוניום H3O+ושארית חומצה. דוגמה: )HCl (g) + H2O (l) H3O+ (aq) + Cl- (aq שם החומצה הנוסחה שם שארית החומצה הנוסחה חומצת מלח HCl יון כלור (כלוריד) Cl- חומצה גפרתית H2SO4 יון גפרתי SO4-2 חומצה גפריתית H2SO3 יון גפריתי SO3-2 חומצה זרחתית H3PO4 יון זרחתי PO4-3 חומצה חנקתית HNO3 יון חנקתי NO3- חומצה פחמתית H2CO3 יון פחמתי CO3-2 חומצה היפוכלורית HClO יון היפוכלורי ClO- בסיסים :לפי ההגדרה הראשונה והמצומצמת ביותר של ארהניוס :בסיס הוא חומר שמשחרר במים את יון ההידרוקסיד )=( OH-1(aqיון הידרוכסיל) .ע"פ הגדרת ברונסטד ולאורי ,בסיסים הם תרכובות המסוגלות לקלוט יוני .H+ בסיסים מורכבים ממתכת ויון/י הידרוקסיד ( .OH-יוצאים מן הכלל :אמוניה ,NH3אשר בהתמוססותה במים יוצרת אמון הידרוקסידי .) NH4OH דוגמה :1בסיס הנתרן (או נתרן הידרוקסידי) .NaOH דוגמה :2בסיס הסידן (או סידן הידרוקסידי) .Ca(OH)2בחומר זה שני יוני הידרוקסיד. בסיסים הם חומרים יוניים (מלבד אמוניה) ורובם מתמוססים במים. דוגמה: )NaOH (s) Na+ (aq) + OH- (aq שם הבסיס בסיס הנתרן /נתרן הידרוקסידי בסיס האשלגן /אשלגן הידרוקסידי בסיס המגנזיום /מגנזיום הידרוקסידי בסיס הסידן /סידן הידרוקסידי בסיס האלומינים /אלומיניום הידרוקסידי אמוניה הנוסחה NaOH KOH Mg(OH)2 Ca(OH)2 Al(OH)3 NH3 חומרים שתמיסתם המימית בסיסית .1תרכובת יונית המכילה יוני הידרוקסיד . OH- לדוגמהNaOH , Ca(OH)2 : ) Na (aq) + OH- (aq [המסה] )NaOH(s .2תרכובת מולקולרית בעלת אטום חנקן Nעם זוג אלקטרונים פנוי .תרכובת הקולטת H+מהמים. )+ OH- (aq )(aq NH3(aq) + H2O(l) NH4 [חומצה בסיס] .3מתכת אלקלית פעילה מטור . 1 לדוגמהNa(s) , K(s) , Cs(s) , Rb(s) : )Na(s) + H2O(l) Na (aq) + ½ H2(g) + OH-(aq נסכם :חומצה -חומר המוסר פרוטון .בסיס -חומר המקבל פרוטון. [חמצון חיזור] תגובות של חומצות ובסיסים א .התכונה הבולטת המאפשרת לזהות חומצות ובסיסים היא התגובה שלהם לחומרי צבע הנקראים בשם :אינדיקטורים, ומשנים את צבעם בהתאם לסביבה שבה הם נמצאים .האינדיקטורים השימושיים ביותר הם: נייר לקמוס ,פנול-פתלאין ,מתיל-אורנג' ומי כרוב. ב .לתמיסה מימית של חומצה pHקטן מ .7 -לתמיסה מימית של בסיס pHגבוה מ.7 - נסכם תמיסה מימית חומצית תמיסה מימית בסיסית תמיסת פנול פתלאין -נשארת שקופה תמיסת פנול פתלאין משתנה לסגול-ורוד נייר לקמוס כחול משתנה לאדום נייר לקמוס כחול -ללא שינוי נייר לקמוס אדום -ללא שינוי נייר לקמוס אדום משתנה לכחול נייר pHבערכיםpH > 7 : נייר pHבערכיםpH < 7 : בתמיסתם המימית יש יוני הידרוניום )H3O+(aq בתמיסתם המימית יש יוני הידרוקסיד )OH-(aq מבחינת המבנה המרחבי הן החומצות החמצניות והן הבסיסים בנויים בצורה זהה לחלוטין כאשר תמיד החמצן מקשר בין האטום המרכזי ובין המימן .מה שקובע את התנהגות החומר כחומצה או כבסיס הוא העובדה -איזה מבין שני הקשרים יהיה זה שיפתח .בחומצות הקשר בין ה O-H -יפתח ,ואילו בבסיסים יפתח הקשר בין היסוד המרכזי לחמצן .בדר"כ כאשר החומר המרכזי מתכת החומר יתפקד כבסיס .אל-מתכת -חומצה .ישנם חומרים אשר להם התכונה לתפקד הן כבסיסים והן כחומצות .אופי התגובה שלהם תלוי בחומר שאיתו הם מגיבים .חומרים אלו נקראים :אמפוטריים. החומצה HClהינה חומצה חזקה ומתפרקת בשלמות במים ל H+ול .Clלמעשה ,החומצה מוסרת את הפרוטון למים ונוצר הצורון הידרוניום ( .)H3O+אבל ,למען הנוחיות ,נוהגים לרשום H+והדבר אינו מפריע בחישובים .כדאי לזכור מדי פעם שלפרוטון בודד אין אפשרות קיום בתמיסה מימית והוא מתחבר מיד עם הווצרו למוקולה של מים .ריכוז היון H+זהה לריכוז החומצה המקורי (מול חומצה נותן מול אחד של יוני H+ומול אחד של .)Cl HCl H+ +Cl באותו אופן הבסיס NaOHשהינו בסיס חזק ,מתפרק בשלמות ליונים Na+ו. OH - פונקציית p הריכוזים של H+ו OH- -שאנחנו מעונינים במדידתם ,הם בדרך כלל קטנים מאחד מולר .שימוש בלוגריתם של הריכוז היה גורם לחוסר נוחיות של עיסוק במספרים שליליים .כדי להימנע מזה ,מגדירים פונקציה : p p ≡ -log בעבודה עם חומצות ובסיסים מבטאים את ריכוז יוני ההידרוניום ( H3O+או ) H+ע"י פונקציה זו, ומדד לחומציות התמיסה הינו רמת ה pH -שלהpH = log[H+]. אם נקח חומצה חזקה כמו ,HClאפשר לתאר את הקשר בין ריכוז החומצה ,ריכוזי ה H+ -וה OH- -וערכי ה pH -וpOH - של התמיסה: ריכוז HClריכוז H+ pH pOH 0.1 M 0.1 M 1.0 13.0 0.01 M 0.01 M 2.0 12.0 או במקרה של תמיסה של :NaOH ריכוז NaOH OH-ריכוז pOH pH 0.1 M 0.1 M 1.0 13.0 0.01 M 0.01 M 2.0 12.0 סקלת הpH - ניטרלי עליה בבסיסיות 14 13 ])(aq 12 - עליה בחומציות ] [OH 11 10 9 8 7 6 5 4 (aq + 3 [H3O 2 1 תגובות סתירה= תגובות של חומצה-בסיס הסתירה של חומצה עם בסיס מבוססות על התגובה: H OH H 2 O חומצות ובסיסים הינן שתי קבוצות חומרים ,בעלי קווי אופי מנוגדים. חומצה זהו חומר המשחרר פרוטונים בתמיסה מימית ואילו בסיס זהו חומר המשחרר יוני הידרוקסיל בתמיסה מימית. חומצות ובסיסים מגיבים ביניהם ליצור מלח ומים .יון H+של החומצה מגיב עם יון ההידררוקסיל OH- ,של הבסיס ושניהם ביחד יוצרים מולקולת מים ,שהיא נייטרלית (מבחינת הגדרת חומצה ובסיס) – תגובה זו היינה תגובת סתירה (נייטרליזציה). לדוגמא תגובה בין HClו NaOH -נוצר מלח בישול ומים: )HCl(aq) + NaOH(aq) NaCl(s) + H2O(l תרגול א .נתונה טבלת חומרים ומידע לגבי התמיסה המימית של כל אחד מהם: חומר .1 )CsOH(s .2 )HNO3(l .3 )NaBr(s .5 )HClO4(l .6 )C2H5OH(l חומצית תמיסה מימית ניטרלית בסיסית רשום ניסוח מתאים לכל אחת מן התמיסות. ב .בחר את התשובה הנכונה ביותר ורשום תהליך מתאים כנימוק: מי מהחומרים הבאים תמיסתו המימית תכחיל נייר לקמוס אדום ? HBr .1 H2SO4 .3 KOH .2 HCl .4 למי מהחומרים הבאים תמיסה מימית בעלת pHשווה ל? 7 - NH3 .1 KI .3 HI .2 ג .נסח תגובות מאוזנות לתהליכים המתוארים ,וציין את סוג התגובה: .1לתמיסה מימית של NaOHמוסיפים תמיסה מימית של .H2SO4 .2לתמיסה מימית של HNO3מוסיפים גבישי . Ba(OH)2 ד .הכינו תמיסה מימית של HIע"י בעבוע הגז למים ,וחלקו את התמיסה ל:2 - .1רשום ניסוח לתגובה של HIעם המים. .2לכל מבחנה הוסיפו :מבחנה NaOH(s) :1 מבחנה HNO3(l) :2 במקרה אחד התרחשה תגובה .נסח את התגובה המתאימה. .3הסבר כיצד יושפע ה[ pH -יעלה/ירד/לא ישתנה] ע"י הוספת החומר למבחנה. חומצות בסיסים -שאלות חישוב .1מערבבים תמיסת 200 HClמ"ל 2Mעם תמיסת 200 NaOHמ"ל .3M מהו תחום ה pH -בתום הערבוב (חומצי/בסיסי/נאטרלי) ? .2מערבבים תמיסת 100 H2SO4מ"ל 2Mעם תמיסת 400 KOHמ"ל .1M מהו תחום ה pH -בתום הערבוב (חומצי/בסיסי/נאטרלי) ? .3מערבבים תמיסת 200 HIמ"ל 1Mעם תמיסת 200 Ba(OH)2מ"ל .0.25M מהו תחום ה pH -בתום הערבוב (חומצי/בסיסי/נאטרלי) ? .4לתמיסת 400 HNO3מ"ל 2Mמוסיפים גבישי . Al(OH)3 מהו תחום ה pH -בתום הערבוב (חומצי/בסיסי/נאטרלי) ? .5ל 150 -מ"ל תמיסת 2M HClמוסיפים 75מ"ל תמיסת CsOHלסתירה מלאה .מהו נפח תמיסת CsOHשהגיב בסתירה ? .6ל 300 -מ"ל תמיסת 1M NaOHהוסיפו תמיסת 0.2M H2SO4עד ל pH -שווה ל7 - מהו ריכוז תמיסת H2SO4שהוסיפו לתגובה ? .7נתונות 2תמיסות 100 HCl - A :מ"ל 200 HCl -B 1Mמ"ל .0.5M איזו תמיסה חומצית יותר ? האם ה pH -זהה בתמיסות ? נמק.