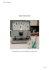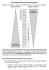Oxidation und Reduktion (Redox
Transcription
Oxidation und Reduktion (Redox
32
Oxidation und Reduktion (Redox-Reaktion)
Redox-Reaktionen bilden die Grundlage für die chemische
Energiespeicherung und -umwandlung:
In der Technik, bei Batterien, Brennstoffzellen und der
Verbrennung,
in der Natur durch die Photosynthese, Atmungskette, Gärung
usw..
Thermit®-Reaktion
Besonders spektakulär ist die Redox-Reaktion zwischen
Eisen(III)oxid und Aluminium ("Thermit®-Reaktion"). Die Reaktion
ist stark exotherm, die Temperaturen werden so hoch, daß
flüssiges Eisen entsteht. Das Verfahren wird unter anderem zum
Verschweißen von Eisenbahnschienen verwendet
Thermit ®-Reaktion
Oxidationsprozesse
Ursprünglich bezeichnete man als
Oxidation nur Reaktionen von organischen
Stoffen, von Metallen etc. mit
(Luft)Sauerstoff, also die Verbrennung von
Holz, Öl, Wachs oder das Rosten von
Eisen
2 Fe + 3 O2 2 Fe2 O 3
Als Reduktion (Sauerstoffentzug) wurde die Gewinnung von Metallen aus den Oxiden bezeichnet.
2 HgO 2 Hg + O2
Es gibt jedoch zahlreiche ähnliche Prozesse, an denen kein Sauerstoff beteiligt ist. Daher wird der
Oxidations-Begriff heute sehr viel weiter gefasst. z. B. Bildung von NaCl aus den Elementen.
Na + Cl2 2 NaCl
Oxidation & Reduktion (= Redox-Reaktion)
Als Oxidation werden solche Prozesse bezeichnet, bei denen ein Atom, Ion oder Molekül
Elektronen abgibt. Aus einem neutralen Atom wird dann ein Kation, beispielsweise aus Kupfer
Cu2+ -Ionen. Dabei ändern sich die Eigenschaften der Materie: Elementares Kupfer ist ein rot
glänzendes, verformbares Metall. Kupferionen bilden dagegen - gemeinsam mit Anionen - Salze
oder liegen gelöst vor. Kupferionen besitzen eine Hydrathülle und sind blau gefärbt.
33
Bei der Reduktion läuft der umgekehrte Vorgang ab: Ein Atom, Ion oder Molekül nimmt
Elektronen auf. In unserem Beispiel nehmen die Cu 2+-Ionen je 2 Elektronen auf und werden wieder
zu elementarem Kupfer.
Oxidationszahlen
Die Oxidationszahl gibt die formale Ladung des jeweiligen Atoms an. Aus der Differenz der
Oxidationszahlen vor und nach der Reaktion ist ersichtlich, wie viele Elektronen das Atom (bzw.
Ion) aufgenommen oder abgegeben hat.
Bei Elementen ist die Oxidationszahl stets = 0:
Bei einfachen Ionen entspricht die Oxidationszahl der
Ladung des Ions:
Bei Molekülen muss die formale Ladung jedes Atoms bestimmt werden. Die Bindungselektronen
werden dem Atom mit der größeren Elektronegativität zugeordnet. Nun wird die
Valenzelektronenzahl des Atoms in der Verbindung mit der Zahl der Außenelektronen im neutralen
Atom (bei Hauptgruppenelementen ist dies die Nummer der Gruppe im alten PSE = römische
Ziffern) verglichen. Die Differenz ergibt die formale Ladung des Atoms in der Verbindung und diese
ist gleich der Oxidationszahl.
Ausschnitt aus dem Periodensystem
rote Zahlen: Elektronegativität
Wichtig: Die Summe der Oxidationszahlen ist in (neutralen) Stoffen/Molekülen Null.
34
Einige wichtige Elemente weisen in den meisten Verbindungen die gleichen Oxidationszahlen auf:
Sauerstoff: fast immer -2 (außer in H2 O2 , dort -1)
Wasserstoff: (fast) immer +1 (außer in Hydriden, z.B. NaH, dort -1)
+
+
Alkalimetalle (Na , K , ...): +1
2+
2+
Erdalkalimetalle (Ca , Ba , ...): +2
–
–
Halogene (F , Cl , ...): -1 ...
Redox-Reaktionen
Da Elektronen nicht frei existieren können, sind Oxidations- und Reduktions-Prozesse stets
miteinander gekoppelt. Eine Redox-Reaktion (hier als Beispiel die Bildung von Zinkoxid aus den
Elementen) kann in zwei Teilreaktionen, die Oxidation und die Reduktion, aufgespalten werden.
Zn + O (= ½ O 2) ZnO
Oxidation:
Zn Zn2+ + 2 e–
Reduktion:
O + 2 e– O 2–
Bei dieser Reaktion gibt Zink Elektronen ab, Zink wird oxidiert. Sauerstoff nimmt Elektronen auf, er
wird reduziert. Den Elektronenlieferanten (Elektronendonor, hier Zink) bezeichnet man als
Reduktionsmittel, die Elektronen aufnehmende Substanz (Elektronenakzeptor , hier Sauerstoff
als Oxidationsmittel.
Zn0
O0 (= ½ O2)
+
Reduktionsmittel
Oxidationsmittel
gibt Elektronen ab
nimmt Elektronen auf
Elektronenlieferant
Elektronendonor
Oxidationszahl
wird erhöht
niedrige Elektronegativität
Elektronenakzeptor
Oxidationszahl
wird erniedrigt
hohe Elektronegativität
Zn+2 O -2
Merke:
Elemente haben stets
die Oxidationszahl 0
(OxZ. = 0)
Reversibilität von Redox-Teilprozessen
Betrachtet wir nun zwei Reaktionen genauer: die Knallgasreaktion, bei der Wasserstoff und
Sauerstoff miteinander reagieren, wobei Wasser entsteht, und die Reaktion von Zink in Salzsäure.
Beide Reaktionen können in die Oxidations- und Reduktions-Teilreaktion aufgespalten werden:
Gesamtreaktion:
2 H2 + O 2
2 H 2O
Zn + 2 HCl
ZnCl2 + H2
Oxidation:
2 H2
4 H+ + 4 e–
Zn
Zn2+ + 2 e–
Reduktion:
O2 + 4 e–
2 O2–
2 H+ + 2 e–
H2
35
In beiden Reaktionen ist eine Teilreaktion enthalten, in der Wasserstoff umgesetzt wird. Bei der
Knallgasreaktion wird Wasserstoff oxidiert, beim Auflösen von Zink in Salzsäure werden Protonen
(Wasserstoff-Ionen) reduziert, wobei Wasserstoff entsteht. Bei der Reduktion von H + zu H2 handelt
es sich also um die Umkehrung der Oxidation von H 2: Redox-Teilprozesse sind umkehrbar.
+
–
2H +2e
H2
Redox-Gleichungen
Komplexere Redox-Gleichungen können unter Anwendung folgenden Schemas erstellt werden:
z.B. Bei der Reaktion von Kaliumpermanganat mit Wasserstoffperoxid in schwefelsaurer Lösung
entstehen Mn(II)-sulfat, Sauerstoffgas, Wasser und Kaliumsulfat. Bestimme die Koeffizienten
(stelle die Reaktionsgleichung richtig!)
KMnO4 + H2O 2 + H2SO4
MnSO4 + O2 + H2O + K2SO4
Reduktion
1. Bestimmung der
Oxidationszahlen
jener Atome, die
sich ändern
2. Elektronenbilanz
Oxidation
+7
KMnO4 –
+7 + 5 e–
+2
–1
0
Mn2+
H2O 2
O2
+2
2 · –1
0 + 2 e–
Elektronenbilanz muss ausgeglichen sein.
= kleinstes gemeinsames Vielfache der Elektronenbilanz = 10
x2
x5
2 KMnO4 + 5 H2O 2 + ? H 2SO4 2 MnSO4 + 5 O 2 + ? K2SO4 + ? H2O
3. Stoffbilanz
Stoffbilanz muss ausgeglichen sein.
links: 2 K
H2O zum Schluss
rechts: K2
links: 3 H 2SO4
rechts: 3 S
links: 16 H
8 H2O
4.
Gesamtgleichung
(Stoffgleichung)
2 KMnO4 + 5 H2 O2 + 3 H2SO4
2 MnSO 4 + 5 O 2 + 8 H2 O
+ K2 SO4
5.
Gesamtgleichung
(Ionengleichung)
2 MnO4– + 5 H2O 2 + 6 H+
2 Mn2+ + 5 O 2 + 8 H2 O
36
Stoffe, die keine Ionen bilden, bleiben unverändert. Von den Ionenverbindungen werden nur jene
positiven/negativen Ionen berücksichtigt, die sich tatsächlich verändern. Als Ionen werden
geschrieben.
Säuren (H + ...)
Basen (... OH- )
Salze: + Teil oder -Teil
Weiters Beispiel:
Durch die Reaktion von Kaliumpermanganat mit Salzsäure entstehen Chlorgas, Kaliumchlorid,
Mangan(II)-chlorid und Wasser.
KMnO4 + HCl
Cl2 + KCl + MnCl 2 + H2O
Reduktion
1. Bestimmung der
Oxidationszahlen
jener Atome, die
sich ändern
2. Elektronenbilanz
Oxidation
+7
+2
KMnO4
–
–
+7 + 5 e
2+
Mn
+2
–1
0
Cl
Cl2
2 · –1
0+2e
–
Elektronenbilanz muss ausgeglichen sein.
= kleinstes gemeinsames Vielfache der Elektronenbilanz = 10
x2
2 KMnO4 + 10 HCl
3. Stoffbilanz
x5
5 Cl2 + 2 MnCl2 + 2 KCl + ? H2O
Stoffbilanz muss ausgeglichen sein.
Da 6 Cl- (für Manganchlorid und Kaliumchlorid) nicht verändert
wurden, müssen diese auf der linken Seite noch dazu gezählt
werden.
H2O zum Schluss
16 HCl
links: 16 H
8 H2O
4.
Gesamtgleichung
(Stoffgleichung)
2 KMnO4 + 16 HCl
5 Cl2 + 2 MnCl2 +
2 KCl + 8 H2 O
5.
Gesamtgleichung
(Ionengleichung)
2 MnO4 – + 16 H+
5 Cl2 + 2 Mn2+ + 8 H2O
Übungsbeispiele für Redox-Reaktionen:
http://www.gym1.at/chemie/pdf7kl/redox2.pdf
37
Elektrochemische Zellen
Redox-Reaktionen können nicht nur
zwischen Feststoffen, sondern auch in
Lösung ablaufen. Wird ein Metall (z. B.
Zink oder Kupfer) in eine Lösung der
entsprechenden Ionen (Zn 2+ bzw.
Cu2+ ) gebracht, erhält man eine
Halbzelle. Es stellt sich ein RedoxGleichgewicht ein:
Zn2+ + 2 e–
Zn
Cu 2+ + 2 e–
Cu
Daniell-Element
Schaltet man eine Kupfer- und eine Zink-Halbzellen zusammen, indem man die Lösungen mit
einer Salzbrücke (einem mit einer Salzlösung gefüllten Rohr) oder einem Diaphragma
(halbdurchlässige Membran) verbindet, so dass eine stromleitende Verbindung entsteht, kann
zwischen den Metallstäben eine Spannung gemessen werden [über die Salzbrücke (Ionenfluss)
ergibt sich ein geschlossener Stromkreis].
Wird der Stromkreis geschlossen, fließen die Elektronen im externen Stromkreis vom unedleren
Metall zum edleren; beim Daniell-Element somit vom Zink zum Kupfer, wobei der Pluspol des
Elements am Kupfer, der Minuspol am Zink liegt.
An der Zink-Elektrode läuft die Oxidation (Zn Zn2+ + 2 e–), an der Kupfer-Halbzelle die Reduktion
(Cu2+ + 2 e– Cu) ab. Die resultierende Redox-Reaktion lautet somit:
CuSO4 + Zn Cu + ZnSO4
Kupfer-Silber-Zelle
Eine Kupfer-Halbzelle kann auch mit einer Halbzelle eines edleren Elementes, beispielsweise
Silber, kombiniert werden.
38
Ag+ + e–
Ag
Cu 2+ + 2 e–
Cu
In diesem Fall erfolgt der Elektronenfluss vom Kupfer zum Silber: Kupfer wird oxidiert, Silber
reduziert. Merke: Die Elektronen fließen vom unedleren zum edleren Metall.
2 AgNO 3 + Cu 2 Ag + Cu(NO3 )2
Galvanische Zellen werden insbesondere zur Energiegewinnung bzw. -speicherung eingesetzt.
Hierzu gehören Taschenbatterien (Trockenelemente) und die wieder aufladbaren Akkumulatoren,
wie z.B. der Blei-Akku.
Blei-Akkumulator
Bleiakkumulatoren bestehen im aufgeladenen Zustand am positiven Pol aus (PbO2), am
negativen aus fein verteiltem, porösem Blei(schwamm). Als Elektrolyt wird 20- bis 40-prozentige
(H2SO4) verwendet. Sie zeichnen sich durch das kurzzeitige Zulassen hoher Stromstärken, die
zum Beispiel für Fahrzeug- bzw. Starterbatterien notwendig sind, aus.
Im entladenen Zustand bestehen beide Pole aus (PbSO 4).
Die Spannung einer Zelle beträgt 2,06 Volt, sie schwankt jedoch je nach Ladezustand und Lade/Entladestrom zwischen ca. 1,75 und 2,4 Volt.
Die Dichte stellt gleichzeitig ein Maß für den Ladezustand des Bleiakkumulators dar. Sie beträgt
bei vollem Akku ca. 1,28 g/cm³ und bei entladenem Akku 1,10 g/cm³
39
Bleiakkumulatoren sollten nicht tiefentladen werden, da dies zu irreparablen Schäden führt und
den Akkumulator unbrauchbar machen kann. Zum Aufladen sollte ein passendes Ladegerät
verwendet werden, um Überladung zu vermeiden und die Gasentwicklung zu beschränken.
Bleiakkus altern: Das liegt in erster Linie an der Veränderung des Bleisulfats. Die „Sulfatierung“
bewirkt, dass sich die PbSO 4-Kristalle zu immer größeren Verbänden zusammenschließen. So
verringert sich die Oberfläche des PbSO4. Durch diese kleinere Oberfläche löst sich das PbSO 4
immer schlechter, so dauert es sehr lange bis eine hinreichend hohe Konzentration an Pb 2+
vorliegt.
Chemische Prozesse: Entladungsreaktionen
Positiver Pol:
Negativer Pol:
Gesamtreaktion:
Beim Laden laufen die Vorgänge in Gegenrichtung ab.
Nickel-Cadmium-Akkumulator
Die Elektroden des NiCd-Akkumulators bestehen in geladenem Zustand aus Platten, die am
Minuspol mit fein verteiltem Cadmium und am Pluspol mit Nickel(III)-oxidhydroxid beladen sind.
Als Elektrolyt wird 20%ige Kalilauge KOH verwendet. Diese Kombination liefert eine Spnnung von
1,3 Volt.
Zukünftig werden Nickel-Metallhydrid-Akkus (NiMH) und Lithium-Systeme mehr Bedeutung
bekommen, da sie höhere
Energiedichten aufweisen und keine umweltschädlichen
Schwermetalle wie Cadmium enthalten.
Entladevorgang: An der negativen Elektrode wird Cadmium zum Cadmiumhydroxid Cd(OH) 2
oxidiert. Die freiwerdenden fließen dann über den Verbraucher zur positiven Elektrode. Dort wird
das Nickel(III)-oxidhydroxid NiOOH zu Nickel(II)hydroxid Ni(OH)2 reduziert.
negativer Pol
positiver Pol
Gesamt-Reaktion
40
Brennstoffzelle
Die Brennstoffzelle ist ein galvanisches Element, in dem durch elektrochemische Oxidation einer
leicht zu oxidierenden Substanz (z.B. Wasserstoff, Methanol) mit Sauerstoff („elektrochemische
Verbrennung“) elektrische Energie erzeugt wird.
Sie besteht aus zwei katalytisch wirksamen, porösen und deshalb für die Reaktionsprodukte
durchlässigen Metallelektroden (Platin, Nickel) oder metallbeschichteten Kohleelektroden,
zwischen denen sich ein Elektrolyt befindet (Phosphor- bzw. Schwefelsäure, Kalilauge oder
ionenleitende keramische Feststoffe ...). Zwischen den beiden Elektrolyten befindet sich eine
Membran:
Das bekannteste Beispiel für eine Brennstoffzelle ist die mit Wasserstoff und Sauerstoff betriebene
Wasserstoff-Sauerstoff-BZ, (oft fälschlicherweise als Knallgaszelle bezeichnet):
Von außen wird unter Druck kontinuierlich Wasserstoff (H2) an die „Brennstoffelektrode“ (Anode),
Sauerstoff (O 2) an die „Oxidatorelektrode“ (Kathode) herangeführt. Die Wasserstoff-Moleküle
werden an der Anode in Wasserstoff-Ionen (Protonen, H +) u. Elektronen (e-) zerlegt:
2 H2 --> 4 H+ + 4 eDie Protonen strömen durch den Elektrolyten zur Kathode, die Elektronen laden die Anode negativ
auf. Die Sauerstoffmoleküle der Kathode werden durch Aufnahme von Elektronen in SauerstoffIonen (O 2-) zerlegt, wobei sich die Kathode positiv auflädt:
O2 + 4 e- --> 2 O2Es entsteht so zwischen den beiden Elektroden eine Spannung von etwa 1 Volt. Verbindet man
beide Elektroden über einen äußeren Stromkreis, an dem ein elektrischer Verbraucher (z.B.
Glühlampe oder Propeller) angeschlossen ist, so fließen die Elektronen über diesen von der Anode
zur Kathode und leisten dabei elektrische Arbeit. An der Kathode verbinden sich die Wasserstoffund Sauerstoff-Ionen zu Wasser, das kontinuierlich aus dem Elektrolyten abgetrennt wird. Die
Gesamtreaktion
2 H2 + O2 --> 2 H2O + E
entspricht der Knallgasreaktion, die durch räumliche Trennung von Oxidation des H 2 und
Reduktion des O2 in kontrollierter Form stattfindet.
Aufgrund der geringen Spannung (1V), die eine einzelne Brennstoffzelle liefert, müssen
gewöhnlich viele Brennstoffzellen zu einer Brennstoffzellen-Batterie zusammen geschaltet werden.
41
Elektrochemische Potentiale
Beim Daniell-Element bildet sich zwischen der Kupfer- und der Zink-Halbzelle ein Potential von
1,11 V aus. Wird statt der Kupfer- eine Silberhalbzelle mit der Zink-Halbzelle verbunden, ergibt
sich ein Potential von 1,57 V (= 1,11 V + 0,46 V).
Vergleicht man die Spannungen zwischen unterschiedlichen Halbzellen, kann man aus den
Spannungen für die Metalle bzw. Redox-Reaktionen charakteristische "Teilspannungen"
bestimmen. Werden diese gegenüber einer Bezugselektrode gemessen, erhält man die
Potentiale der jeweiligen Halbzellen. Als Bezugssystem dient die StandardwasserstoffElektrode.
Standardwasserstoff-Elektrode
Die Standardwasserstoff-Elektrode wurde
früher als Normalwasserstoffelektrode
bezeichnet.
Der Standardwasserstoff-Elektrode wurde als Referenzelektrode das Potential 0 V zugewiesen.
Alle anderen Redox-Potentiale werden auf diese Halbzelle bezogen. Bei dieser Zelle befindet sich
ein Platinblech in einer Lösung mit dem pH-Wert 0. Umspült wird diese Platinelektrode mit
Wasserstoff unter einem Druck von 1,013 bar.
Die Spannungsreihe
In der "Spannungsreihe" werden die Elemente nach ihrem Standardpotential (früher:
Normalpotential) geordnet. Diese Potentiale werden auf die Standardwasserstoff-Elektrode
bezogen, d.h. das Redox-Potential des Wasserstoffs wird mit 0 V definiert. Je positiver das
Potential ist, desto "edler" ist das Metall.
Metalle mit negativem Potential bezeichnet man als unedel. Bringt man eine Halbzelle eines
unedlen Metalles mit der Standardwasserstoff-Elektrode in Kontakt, fließen die Elektronen von der
42
Halbzelle (unedles Metall) zur Wasserstoffelektrode. Unedle Metalle reagieren mit verdünnten
Säuren unter Wasserstoffentwicklung. Metalle mit positiven Potentialen nennt man edel. Wird eine
Halbzelle eines edlen Elementes mit der Standardwasserstoff-Elektrode verbunden, fließen die
Elektronen zur Halbzelle des edlen Elements.
oxidierte Form
+
reduzierte Form
Standardpotential
Na
E o = – 2,71 V
Zn2+ + 2 e–
Zn
E o = – 0,76 V
Fe2+ + 2 e –
Fe
E o = – 0,40 V
Sn2+ + 2 e–
Sn
E o = – 0,14 V
2 H3O + + 2 e–
H2 + 2 H2O
Cu 2+ + 2 e–
Cu
Eo = + 0,34 V
Ag+ + e–
Ag
Eo = + 0,80 V
Hg 2+ + 2 e–
Hg
Eo = + 0,85 V
O 2 + 2 H2 O + 4 e –
4 OH–
Eo = + 1,23 V
Au 3+ + 3 e–
Au
Eo = + 1,50 V
Na + e
–
Eo =
0,00 V
Die Standardpotentiale werden bei Standardbedingungen (25°C, 1,013 bar) bei 1 -molaren
Lösungen gemessen. Die Redox-Reaktionen werden stets als Reduktionen geschrieben. Wird eine
Gleichung "umgedreht", ändert sich das Vorzeichen des Potentials.
Die Spannungsreihe erlaubt Voraussagen, welche Redoxreaktionen spontan (freiwillig) ablaufen
können. Die Elektronen fließen stets vom unedleren Metall zum edleren, das unedlere Metall wird
also oxidiert, das edlere reduziert:
Wird elementares Zink zu einer Silbersalzlösung gegeben, wird Zink zu Zn 2+ oxidiert, Ag+ zu Silber
reduziert. Wird statt dessen zur Silbersalzlösung Gold gegeben, erfolgt keine Reaktion. Gold ist
erheblich edler als Silber und wird damit von Ag + nicht oxidiert.
In die Spannungsreihe können nun auch andere Redox-Systeme eingeordnet werden,
beispielsweise:
Cl2 + 2 e–
2 Cl–
–
–
+
MnO4 + 3 e + 4 H
MnO2 + 2 H2 O
Auch für diese Vorgänge können Standardpotentiale bestimmt werden.
Spannungsreihe, die auch Nichtmetalle enthält:
http://www.gym1.at/chemie/pdf7kl/spannrei.pdf
Nernstsche Gleichung
Die Redox-Potentiale sind abhängig von den Konzentrationen der reduzierten und oxidierten Form.
Die Nernstsche Gleichung beschreibt diese Beziehung:
E=
E° =
R=
T=
z=
F=
Potential
Standard-Potential (25°C, 1-molare Lösungen)
Gaskonstante
(absolute) Temperatur in K
Zahl der bei der Reaktion übertragenen Elektronen
Faraday-Konstante
43
Setzt man in die Nernstsche Gleichung die Standard-Temperatur (25°C = 298 K) sowie die
Zahlenwerte für R und F ein, und formt den natürlichen Logarithmus in den dekadischen um,
vereinfacht sich die Gleichung:
Anwendung der Nernstschen Gleichung
Mit dieser Gleichung ist es nun möglich, Potentiale von Zellen zu berechnen, die nicht 1-molare
Lösungen enthalten. Als Beispiel sollen Silberhalbzellen mit unterschiedlicher SilberionenKonzentration dienen:
Ag + + e–
Ag
Eo = + 0,80 V
Die reduzierte Form ist elementares Silber: [Red] = [Ag] = 1.
Bei der Reaktion wird ein Elektron übertragen: z = 1.
Die Nernstsche Gleichung lautet für dieses Redox-Gleichgewicht:
E = 0,80 V + 0,06 V · log [Ag +]
Zelle 1:
[Ag +] = 0,1 mol/l
E1 = 0,80 V + 0,06 V · log (0,1) = 0,80 V + 0,06 V · (–1) = 0,80 V – 0,06 V = 0,74 V
Das Potential dieser Zelle ist also etwas kleiner als das Standardpotential (bei [Ag+] = 1 mol/l).
Zelle 2:
[Ag +] = 0,01 mol/l
E2 = 0,80 V + 0,06 V · log (0,01) = 0,80 V + 0,06 V · (–2) = 0,80 V – 0,12 V = 0,68 V
Werden diese beiden Zellen miteinander verbunden, misst man zwischen den Elektroden eine
Spannung von:
E = |E1 – E2 | = |0,74 V – 0,68 V| = 0,06 V
44
Elektrolyse
Die Vorgänge in einer elektrochemischen Zelle lassen sich auch umkehren. Wird an die Elektroden
eine Spannung angelegt, erfolgt eine Elektrolyse. Bei der Elektrolyse wird die Säure-, Base- oder
Salzlösung (oder Salzschmelze) zersetzt.
Grundlagen:
Salze, Säuren und Basen zerfallen beim Lösen
in ihre Ionen (= Elektrolyt).
Beim Anlegen einer Gleichspannung an die
Elektroden wandern die positiven Kationen zur
Kathode (-Pol), erhalten Elektronen und werden
reduziert.
Die negativen Anionen wandern zur Anode
(+Pol), geben dort Elektronen ab und werden
oxidiert.
KATION: +positves Ion; ANION: -negatives Ion
http://www.chemie-webverzeichnis.de/experiment-fotos/
http://www.pc.chemie.uni-siegen.de/pci/versuche/v21-2.html
Elektrolyse einer Kupferchlorid-Lsg:
An die beiden Elektroden wird eine Spannung
angelegt. Aufgrund der elektrostatischen
Anziehung wandern die positiv geladenen
Kationen (Cu2+) zum Minuspol, zur Kathode. Die
Anionen (Cl–) werden vom Pluspol, der Anode,
angezogen. An den Elektroden laufen nun
Redox-Vorgänge ab:
Kathode: Cu 2+ + 2 e–
Anode:
2 Cl–
Cu
Reduktion
Cl2 + 2 e– Oxidation
Durch Elektrolyse können viele Metalle chemisch rein aus ihren Verbindungen gewonnen werden.
Die Elektrolyse in wässriger Lösung ist (im Regelfall) jedoch nur bei edlen Metallen (E° > 0 V)
möglich. Bei unedlen Metallen würde sich nicht das Metall abscheiden, sondern Wasserstoff
entstehen.
http://www2.chemie.uni-erlangen.de/projects/vsc/chemie-medizinerneu/bindung/metallbindung.html
45
Elektrolyse einer Kochsalz-Lösung
In wässriger Lösung gibt es neben den Na + und Cl- -Ionen auch die Dissoziationsprodukte des
Wassers H3O + (H+) und OH - . Legt man an den Elektroden eine Spannung an, werden bevorzugt
die Ionen entladen, die die geringste Zersetzungsspannung benötigen. Im vorliegenden Fall sind
dies die Chlorid- und die Hydronium(Wasserstoff)-Ionen. Zurück bleiben die Natrium- und die
Hydroxidionen, die die Natronlauge bilden. (Normalpotentiale der Stoffe in der Spannungsreihe!)
Kathodenreaktion: (Konkurrenz: H+ und Na+)
4 H2O → 2 H3O + + 2OH- - einfacher: (2 H2O → 2 H+ + 2 OH -) - Dissoziation des Wassers
2 NaCl → 2 Na+ + 2 Cl 2 H+ + 2 e- → H2 Kathodenreaktion
2 H 2O + 2 e → H2 + 2 OH- Gesamtreaktion im Kathodenraum
Anodenreaktion: (Konkurrenz: Cl- und OH-)
2 H2O → 2 H+ + 2 OH 2 NaCl → 2 Na+ + 2 Cl- Dissoziation des Steinsalzes
2 Cl- → Cl2 + 2 e - Anodenreaktion
2 NaCl → 2 Na+ + Cl2 + 2e- Gesamtreaktion im Anodenraum
Gesamtreaktion
2 H2O + 2 NaCl → H2 + Cl2 + 2 (Na+ OH- )
Diaphragma-Verfahren: Elektrolyse einer
gesättigten Kochsalz-Lösung in der Praxis
Elektrolyse von Wasser (schwefelsaure Lösung)
Kathodenreaktion: Reduktion von H+
2 H2O → 2 H + + 2 OH H2SO4 → 2 H+ + SO4 22 H+ + 2 e- → H2 (Kathodenreaktion) (x 2)
Anodenreaktion: Oxidation von OH -)
2 H2O → 2 H+ + 2 OHH2SO4 → 2 H+ + SO 4 24 OH- → O 2 + 2 H2O + 4 e- (Anodenreaktion)
Gesamtreaktion
2 H2O → 2 H2 + O2
Hoffmannscher Wasserzersetzungsapparat
46
Korrosion & Korrosionsschutz
Unedle Metalle werden von Luftsauerstoff oxidiert. Bildet sich dabei eine dichte Oxidschicht auf der
Metalloberfläche, z.B. bei Aluminium, ist das Metall von einem weiteren Angriff geschützt. Dieser
Vorgang wird als Passivierung bezeichnet. Bei Eisen ist die entstehende Oxidschicht porös. Der
Oxidationsprozess kann sich auf das ganze Metall ausdehnen, es bleibt nur Eisenoxid zurück.
Durch Salzlösungen wird die Oxidation noch beschleunigt.
Um die Korrosion von Bauteilen aus Eisen oder Stahl zu verhindern, können Legierungen mit
Metallen erzeugt werden, die edler sind und eine stabile Oxidschicht ausbilden (Edelstahl). Eine
weitere Möglichkeit ist die Beschichtung mit einem anderen Metall. Ist das Überzugsmetall edler
als Eisen, beispielsweise Zinn, ist der Korrosionsschutz nur gewährleistet, wenn der Metallüberzug
nicht beschädigt wird. Wird die Eisenoberfläche freigelegt, kann sich an der Grenzschicht zwischen
Zinn und Eisen ein sog. „Lokalelement“ ausbilden. Elektronen fließen vom unedleren Eisen zum
edleren Zinn, die Oxidation von Eisen wird begünstigt.
Umgekehrt kann die Lokalelement-Bildung auch als Korrosionsschutz eingesetzt werden. Wird
Eisen mit einem unedleren Metall verbunden, entsteht bei der Oxidation des unedleren Metalls ein
Elektronenfluss zum Eisen. Dadurch wird das Bauteil vor einem Angriff geschützt.
Experiment des Monats 07/1998
In dem abgebildeten Experiment befinden sich
Eisennägel in einer Kochsalzlösung, der als
Indikator
Kaliumhexacyanoferrat(III)
zugesetzt
wurde. Durch Luftsauerstoff wird Eisen zu Fe 2+Ionen oxidiert. Die Eisenionen bilden mit dem
Hexacyanoferrat einen tiefblauen Komplex. Am
mittleren Nagel tritt nach 15-30 Minuten eine
Blaufärbung ein. Der linke Nagel steht in Kontakt
mit einem Kupferblech, also einem edleren
Element. Es liegt ein Lokalelement vor, das die
Oxidation des Eisens erheblich beschleunigt. Die
Blaufärbung beginnt bereits nach wenigen Minuten.
Der rechte Nagel ist mit dem unedleren Zink
verbunden. Bei diesem Lokalelement wird das Zink
oxidiert, es wirkt als "Opferanode". Eisen ist vor
Korrosion geschützt, eine Blaufärbung bleibt aus.
Opferanoden (also Stäbe oder Blöcke aus einem
unedleren Metall, z.B. Zink oder Magnesium, die
leitend
mit
zu
schützenden
Eisen-Bauteil
verbunden sind) werden beispielsweise bei
Rohrleitungen,
Brücken
und
Tanks
als
Korrosionsschutz eingesetzt
Lokalelemente
bei AmalgamFüllungen
In der Zahnheilkunde werden seit Jahrhunderten Amalgame (Legierungen von Quecksilber mit
anderen Metallen) als Füllmasse verwendet. Heute sind Legierungen gebräuchlich, die neben
Quecksilber Silber, Kupfer und Zinn enthalten. Unmittelbar nach Legen der Füllung beginnt die
Oxidation durch Luftsauerstoff. Dabei wird fast ausschließlich das unedelste Element, also Zinn,
oxidiert. Es bildet sich auf der Füllung eine Zinnoxid-Schicht, die nach einigen Tagen die Füllung
vollständig isoliert. Zu Beginn werden auch sehr kleine Mengen Quecksilber frei, nach 2 - 3
Wochen ist jedoch keine Quecksilber-Freisetzung mehr nachweisbar.
Wird nun jedoch in Nachbarschaft der Amalgam-Füllung ein edleres Metall eingebracht,
beispielsweise Gold, kann sich ein Lokalelement ausbilden. Voraussetzung ist, dass eine
47
elektrisch leitende Verbindung zwischen beiden Materialien vorliegt. Dies kann durch direkten
Kontakt oder über Zahnbein und Kiefer geschehen.
Metalle im Amalgam: Sn, Cu, Ag, Hg
Sn2+ + 2 e–
Sn
E° = –0,14 V
Hg2+ + 2 e–
Hg
E° = +0,85 V
Sauerstoff:
O 2 + 2 H2 O + 2 e–
4 OH–
E° = +1,24 V
Gold:
Au3+ + 3 e–
Au
E° = +1,50 V
Bei der Ausbildung des Lokalelementes erfolgt eine stark beschleunigte Korrosion der unedleren
Metalle. Insbesondere Zinn wird verstärkt oxidiert und die Elektronen werden an das Gold
weitergeleitet. An der Goldoberfläche nehmen Sauerstoffmoleküle die Elektronen auf und werden
reduziert. Bei diesem Gesamtprozess werden neben Zinn auch kleine Mengen der anderen
Amalgam-Metalle oxidiert, also auch Kupfer, Silber und Quecksilber. Die entstandenen Ionen lösen
sich im Speichel und können im Verdauungstrakt resorbiert werden. Gesundheitliche
Beeinträchtigungen durch Quecksilber-Ionen sind in diesem Fall nicht auszuschließen.
Opferanoden im Schiffsbau
Eine Opferandode ist Bestandteil des Opferanode an einem Schiffsrumpf
Korrosionsschutzes an einem Schiffsrumpf,
genauer am Unterwasserschiff (d.h. der Teil
des Schiffsrumpfes, der sich unter Wasser
befindet). Eine Opferanode besteht meist aus
einem Stück Zink, das wenige Kilogramm
schwer
ist
und
am
Rumpf
mittels
Stahlhalterungen befestigt ist.
Eine Opferanode nutzt die elektrochemische
Spannungsreihe von Metallen aus. Diese
Spannungsreihe verursacht folgendes: gibt
man zwei miteinander verbundene und
unterschiedlich edle Metalle (z.B. Eisen und
Zink) in eine elektrisch leitfähige Lösung (z.B.
Salzwasser), dann fließt ein Strom, wobei sich
das unedlere Metall auflöst.
An einem Schiff hat man z.B. den Stahlrumpf
und den Propeller aus Bronze. Hier würde ein
elektrischer Strom fließen und der Stahlrumpf
würde korrodieren. Ist aber eine Opferanode
(das Stück Zink) montiert, dann löst sich
langsam das Zink auf und schützt so den
Rumpf vor Korrosion.