SEMINAR2_do konca_zimski semester
Transcription
SEMINAR2_do konca_zimski semester
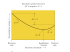
Kisline, baze in soli. Nevtralizacijska titracija. 1 Arrheniusova definicija • Kisline so elektroliti, ki v vodni raztopini disociirajo vodikove ione : • HCl(g) → H+(aq) + Cl-(aq) • Baze so elektroliti, ki v vodni raztopini disociirajo hidroksidne ione: • NaOH (s) → Na+(aq) + OH-(aq) • Arrheniusova definicija → vodne raztopine. • Jakost kislin in baz →(α α), Kdisoc • Nevtralizacija → ionska reakcija • H+ + Cl- + Na+ + OH- = Na+ + Cl- + H2O 2 Brönsted • Kisline so spojine , ki oddajo protone. • Baze so spojine, ki vežejo protone. • Kislina vselej odda proton bazi. To reakcijo imenujemo protolitska reakcija, v njej sodelujeta dve kislini in dve bazi. • HCl + kislina A H2O baza B ⇔ H3O+ + kislina B Clbaza A • Ko snov odda proton, postane konjugirana baza; ko snov sprejme proton; postane konjugirana kislina. V raztopinah sta sprejemanje in oddajanje protonov v ravnotežju. • HCl/Cl- in H3O+/H2O ........konjugirana kislinsko bazna para 3 4 5 Titracija Merimo volumen reagenta znane koncentracije, da lahko izračunamo koncentracijo drugega reagenta. Med reagenti teče kemijska reakcija . Ko je reakcija končana, smo dosegli ekvivalentno točko. Dodali smo toliko ml reagenta, kot je potrebno za popolno reakcijo z vzorcem. To točko nam pokaže indikator, ki v ekvivalentni točki spremeni barvo. Reakcija: HCl + NaOH → NaCl + H2O 6 Indikatorji so šibke organske kisline ali baze, pri katerih je kislina (HInd) drugače obarvana od konjugirane baze (Ind-) Odvisnost protolitskega ravnotežja od pH : HInd + H2O ⇔ H3O+ + Ind [H3 O + ][Ind.- ] Ka = [H Ind.] ali pH= pKa + log [Ind.-]/ [H Ind.] 7 pH = pKa(HInd) točka preskoka V praksi razširimo optično zaznavo, saj mešanico barv pri zgornjem pogoju težko določimo. Če spremenimo razmerje [Ind.-]/ [H Ind.] od 10:1 do 1:10 , pomeni pH = pKa ± 1, (2 enoti pH), se spremeni tudi barvaobmočje preskoka. Uporabljamo jih za ugotavljanje ekvivalentne točke pri titracijah 8 4,4-6,2 6.2-7.7 pH = pKa ±1 = območje preskoka indikatorja 8,2-10,0 9 Postopno dodajanje neke baze h kislini (alkalimetrija) oz. neke kisline k bazi (acidimetrija) imenujemo titracija. Primer: Titracija močne kisline z močno bazo: 10,0 ml 0,1M HCl (začetni pH = 1) dodajamo po 1,0 ml 0,1M NaOH tako, da dodamo skupno 15,0 ml raztopine NaOH! Grafično nam prikazuje spremembo pH v odvisnosti od V (mL) dodanega NaOH spodnja titracijska krivulja. Na krivulji opazimo, da se pH na začetku , ko je v prebitku močna kislina le malo spreminja . Ko je porabljene 90% kisline pH naraste od 1 na 2, pri 99% porabi kisline pa od 1 na 3. Sledi območje, ko pH močno “skoči” pri le malem dodatku baze (npr. 1 kapljica). Pri točno 10 mL dodatka baze dosežemo t.i. ekvivalentno točko, ki leži v našem primeru pri pH=7 in sovpada z nevtralno točko (po def. pH=7) Po tej točki, raste pH, saj ga določa le še NaOH. 10 Kislinsko bazne titracije pH Ekvivalentna in nevtralna točka Začetni pH Titracijska krivulja za HCl (0,1MHCl in 0,1M NaOH) 11 12 Naloge 1. Računski nalogi a) Izračunajte množinsko koncentracijo raztopine, če v 250 mL merilni bučki zmešamo 10 g Na2CO3, 10 g Na2CO3 x 10 H2O, 10 g 5% raztopine Na2CO3 in 10 mL raztopine Na2CO3 z množinsko koncentracijo 1 mol/L, ter dopolnimo dobljeno raztopino z destilirano vodo do oznake! b) 12 mL HCl z množinsko koncentracijo 1 mol/L nevtralizira 1 g trdne zmesi KOH in Ba(OH)2. Izračunajte masni delež KOH v prvotni zmesi! 13 Primer 2: Raztopini NaOH želimo določiti koncentracijo. V erlenmajerico odmerimo s pipeto točno določeno prostornino raztopine NaOH (n. pr. 25,0 mL) in ji dodamo nekaj kapljic indikatorja metiloranž. Z bireto dodajamo standardno raztopino HCl (n.pr. 0,100 M HCl), dokler raztopina v erlenmajerici ne spremeni barve (v primeru navedene titracije iz rumene v čebulno - rjavo). Bireta omogoča dodajanje raztopine po kapljicah (pri standardnih biretah je prostornina kapljice 0,03 mL). Tako lahko z malo vaje določimo ekvivalentno točko z natančnostjo ±0,03 mL ali kot rečemo v žargonu »na eno kapljico natančno«. Titracijo vedno večkrat ponovimo. Recimo, da smo pri treh titracijah, pri katerih smo vedno titrirali 25,0 mL raztopine NaOH, porabili (dodali toliko 0,100 M HCl, da smo dosegli ekvivalentno točko): V1(0,100 M HCl) = 22,2 mL V2(0,100 M HCl) = 22,2 mL V3(0,100 M HCl) = 22,3 mL (R: 0,0889 mol/L NaOH) 14 3. 10,0 g natrijevega hidroksida si raztopil v vodi in raztopino razredčil v 1000 mL merilni bučki. Pri titraciji 20,0 mL razredčene raztopine si porabil 16,0 mL 0,125 M H2SO4. Koliko % nečistoč vsebuje natrijev hidroksid? • (R: 2,00 g nečistoč oziroma 20,0 % nečistoč) 15 Titracija, Nevtralizacija 1. Za popolno obarjanje 40,0 mL raztopine AgNO3 potrebuješ 36,0 mL 0,50 M NaCl. Izračunaj molarnost raztopine AgNO3! (R: 0,45 M AgNO3) 2. Če v 100 mL raztopine AgNO3 uvedeš 2,50 L plinastega HCl, merjenega pri temperaturi 27 °C in tlaku 99,8 kPa, oboriš vse srebro v obliki trdnega AgCl. Izračunaj masno koncentracijo raztopine AgNO3! (R: 170 g/L) 3. 50,0 mililitrom raztopine HCl si dodal 100 mL 0,10 M NaOH. Za nevtralizacijo prebitnega NaOH si porabil 25,0 mL 0,050 M HCl. Izračunaj molarnost prve raztopine HCl! (R: 0,175 M HCl) 4. 1,43 g Na2CO3.×H2O si raztopil v vodi in razredčil na 250 mL. Pri titraciji 25,0 mL te raztopine si porabil 49,95 mL 0,0100 M žveplove (VI) kisline. S koliko molekulami vode (R: Na2CO3×10H2O) 16 kristalizira natrijev karbonat? 5. 20,0 mL 2,0 M HCl razredčiš na 500 mL. Koliko mL 0,1 M NaOH porabiš pri titraciji 25,0 mL razredčene raztopine? 20 mL 6. Koliko mL 1,18 M NaOH potrebuješ za nevtralizacijo 25,0 mL 0,295 M H2SO4? 12,5 mL 7. 15,0 mL 10 % raztopine H2SO4 z gostoto 1,070 g mL-1(20°C) razredčiš na 250 mL. Pri titraciji 20,0 mL razredčene raztopine porabiš 10,0 mL raztopine NaOH. Izračunaj molarnost raztopine NaOH! 0,262 M 8. Koliko litrov plinastega HCL pri 105 kPa in 30 °C, moraš uvesti v 250 mL 2,0 M NaOH, da bo hidroksid popolnoma nevtraliziran? 12,4 L 9. Za nevtralizacijo raztopine alkalijskega hidroksida si porabil 45,0 mL 0,120 M HCl. Po izparevanju in sušenju si dobil 0,403 g trdne soli. Izračunaj molsko maso soli! 74,6 g/mol 17 Elektrolitska disociacija • Elektroliti so snovi, katerih vodne raztopine prevajajo električni tok. • Prevodnost raztopin elektrolitov je posledica elektrolitske disociacijespontanega razpada molekul topljenca na ione (Arrhenius). • Ionizacija : HCl(aq) ⇒ H+(aq) + Cl-(aq) • Večina elektrolitov pa je tudi v čisti obliki ionsko zgrajena (npr.vse soli, NaOH...) • Pri disociaciji ionska snov razpade na ione v raztopini (poruši se ionska mreža): NaOH(s) ⇒ Na+(aq) + OH-(aq) NaCl(aq) ⇒ Na+(aq) + Cl-(aq) Raztopine elektrolitov dobijo nove lastnosti, ki jih izhodne snovi niso imele. • Te spremembe so posledica posebno močne interakcije - medsebojnega delovanja, med molekulami vode in topljenca. Ta pojav imenujemo elektrolitska disociacija. 18 IONSKE REAKCIJE. Destilacija in retitracija So reakcije med raztopinami elektrolitov. Pogoj, da pride do reakcije med ioni raztopljene snovi je: 1. nastanek lahko hlapne spojine 2. nastanek težko topne spojine 3. nastanek slabo disociirane spojine Do reakcij med elektroliti običajno ne pride, ker so ioni hidratizirani in se pogosto ne privlačijo. Značilnost ionskih reakcij je, da niso ravnotežne oz. Krav >> 1, so hitre in večinoma potečejo do konca. 19 1. nastanek lahko hlapne spojine: Ionska reakcija: Neto ionska reakcija: 20 Primer: 21 2. nastanek težko topne spojine: 22 23 24 25 26 3. nastanek slabo disociirane spojine 27 50 mL 2M, NaOH NH3 vzorec NH4Cl 50mL 0,1 M HCl 28 Stehiometrijsko razmerje za izračun mase NH4Cl: n (NH4Cl) = n (HCl) n1(HCl) = 50mL x 0,1 mol/L = 5 mmol n2(HCl) = V(NaOH) x 0,1 mol/L titracija n (NH4Cl) = n1(HCl) - n2(HCl) m(NH4Cl)= n x M(NH4Cl) Bučka: NH4Cl + NaOH → Erlenmajerica: HCl + NH3(aq) → 29 Stopnja protolize(disociacije) α - merilo za jakost elektrolita α = N/N0 = n/n0= cd/c α = stopnja protolize (disociacije) N = število disociiranih molekul (HCl) oz. formulskih enot (NaCl) N0= število vseh molekul v raztopini cd =konc. disoc. molekul c= konc. vseh molekul(analitska konc.) močni elektroliti: α > 0,8 šibki elektroliti : α < 0,3 neelektroliti : α = 0 30 Npr.: α α HCl 0.784 KOH 0.77 H2SO4 0.510 NaOH 0.73 HF 0.70 Ba(OH)2 0.69 HCN 0.0001 NH4OH 0.004 31 Naloge: 1. Izračunaj masno koncentracijo kloridnih ionov v 0,0512 M MgCl2! Predpostavi popolno disociacijo! Popolna disociacija α = 1 (močan elektrolit) H2O(l) MgCl2(s) → Mg2+(aq) + 2Cl-(aq) Lahko pišemo tudi: MgCl2(aq) → Mg2+(aq) + 2Cl-(aq) ali enostavno: MgCl2 → Mg2+ + 2Cl- 32 2. V 1,00 mL 0,030 M CH3COOH je 4,3.1017 acetatnih ionov CH3COO-. Izračunaj stopnjo ionizacije v 0,030 M CH3COOH! CH3COOH(aq) + H2O(l) ⇔ H3O+ (aq) + CH3COO- (aq) H2O(l) CH3COOH(l) → CH3COOH(aq) Čista ocetna kislina je molekulsko zgrajena in je pri sobni temperaturi tekoča. Če nekaj ocetne kisline raztopimo v vodi, dobimo vodno raztopino ocetne kisline! 33 3. 28,1 mL NH3 plina pri 20°C in 86,65 kPa uvedeš v 100 mL vode. Koncentracija hidroksidnih ionov v dobljeni raztopini je 1,3.10-4 molL-1. Izračunaj stopnjo protolize raztopljenega NH3! Spremembo prostornine pri uvajanju NH3 zanemari! 4. 8,00g NaOH raztopiš v vodi in razredčiš na 250 mL. Izračunaj molarnost natrijevih ionov v raztopini! Predpostavi popolno disociacijo! 34 5. V enem litru vode si raztopil 30 g KNO3 in 40 g NaNO3. Gostota dobljene raztopine pri 20°C je 1,07 g/mL. Izračunaj molarnost nitratnih ionov v raztopini. Predpostavi popolno disociacijo! 6. Koliko gramov Cu(OH)2 se izloči iz raztopine, če zmešamo 100 mL 0,10 M KOH in 100 mL 0,10 M Cu(NO3)2 ? 7. Če v 100 mL raztopine AgNO3 uvedeš 2,50 L plinastega HCl, merjenega pri 27°C in tlaku 99,8 kPa, oboriš vse srebro v obliki trdnega AgCl. Izračunaj masno koncentracijo raztopine AgNO3! 35 Opredelitev jakosti kislin in baz s stopnjo protolize(disociacije) Ostwald (1953): za ravnotežje med ioni in nedisociiranimi molekulami je uporabil zakon o vplivu mas: CH3COOH H+ + CH3COO– c ( 1– α) c α + c α Kdis. = [H+].[CH3COO–] / [CH3COOH] Kdis. = cα × cα / c(1– α) = cα2 /(1– α) α2 + (Kdis / c)α – Kdis /c = 0 Ta zakon ravnotežja velja le za razredčene vodne raztopine šibkih elektrolitov (Kdis.< 1.10-4) 36 Kdisoc. = cα2 / 1-α pribl. formula za α << 1 : K disoc. ≈ cα2 /1 Kdisoc. = cα2 α = √K/c 37 Kadar α ni zanemarljiv uporabljamo kvadratno enačbo: Kdisoc.= cα2 / 1-α α2 + (Kd / c) α - (Kd / c) = 0 a b c koreni kvadratne enačbe 2 - 4ac )/ 2a α √ b = ( -b + 1 2 1α 2 = ( -Kd /c + √ (Kd /c )2 – 4(Kd /c) ) 2 38 Vodne raztopine šibkih kisli in baz Zelo malo K in B močno disociira ali sprejema protone. Večina jih je šibkih. Relativno” moč” K in B lahko izrazimo s KONSTANTO RAVNOTEŽJA, ki jo za šibko kislino zapišemo: HA(aq) + H2O(l) ⇔ H3O+ (aq) + A-(aq) + - [H3O ][A ] Ka = [HA] 39 • Ravnotežje ocetne kisline v vodni raztopini je podano z naslednjo zvezo: CH3COOH(aq) + H2O(l) H3O+(aq) + CH3COO–(aq) + - [H3 O ][CH3COO ] Ka = [CH3COOH] Kadar je Ka velika, pomeni, da je ravnotežje reakcije pomaknjeno v desno. Kislina je močna. Nizka vrednost Ka pomeni, da je kislina šibka. 40 šibka baza: B(aq) + H2O(l) ⇔ BH+(aq) + OH-(aq) + - [BH ][OH ] Kb = [B] MOČNE KISLINE, MOČNE BAZE ŠIBKE KISLINE, ŠIBKE BAZE K >> 1 K << 1 41 Disociacijske konstante nekaterih kislin v vodi (25 ºC) : Disociacijske konstante nekaterih baz v vodi (25 ºC) : Kislina Ka CH3COOH C3H6O3 1,76 × 10–5 1,4 x 10-4 4,75 3,85 NH3 1,77 × 10–5 4,75 HF 5,62× 10–4 3,25 C2H5NH2 5,62 × 10–4 3,25 HClO 3,72× 10–8 7,43 B(OH)3.H2O 7,3 x 10-10 9,14 (C2H5 )2NH 9,55 × 10–4 3,02 C6H5NH2 3,80 × 10–10 9,42 pKa H2SO4 103 –3 HSO4- 1,2× 10–2 1,92 HClO4 109 –9 HNO3 20 –1,3 Baza Kb pKb 42 Aplikacija ZDM na disociacijo vode- pH Kw = [H3O+][OH-] = 1.0 x 10-14 (pri 22 °C) ionski produkt vode V čisti vodi velja [H3O+] = [OH–]…nevtralna raztopina pri 22 oC [ H3O+ ] = Kw1/2 = 1x10–7 mol/L • [ H3O+ ] > [ OH–]………….kisla raztopina • [ H3O+ ] < [ OH–]…………bazična raztopina 43 Sørensen (1909): •pH(raztopin) = –log[H3O+] do H3O+ = 0,1 mol/L •pOH(raztopin) = –log[OH-] •pH + pOH = 14 sicer pH = –log a(H3O+) za celotno konc. območje 44 • Šibka kislina [H+] = √Kk.ck • Šibka baza [OH-] = √Kb.cb • Močna kislina [ H +] = c k • Močna baza [OH- ] = cb 45 Kemijsko ravnotežje. Ravnotežna konstanta kemijske reakcije. 1. Računske naloge: a) Konstanta Ka (CH3COOH) = 1,74 . 10-5. Izračunajte stopnjo disociacije ocetne kisline s koncentracijo 0,01 mol/L ! 1) po približni formuli 2) po kvadratni enačbi b) Izračunajte pH 0,1 M baze s stopnjo disociacije........! c) Izračunajte množinsko koncentracijo (molarnost) ..........., ki ima pH = ...... in Kd = ....... Delež disociiranih molekul je zanemarljiv. 46 Kemijsko ravnotežje. Protolitska ravnotežja v vodnih raztopinah 1.a)Titracija močne kisline z močno bazo: 10,0 ml 0,1M HCl dodajamo po 1,0 ml 0,1M NaOH tako, da dodamo skupno 20,0 ml raztopine NaOH! HCl + NaOH → NaCl + H2O Kdisoc.=1.74x10-5 1.b) Titracija šibke kisline z močno bazo: 10 ml 0.1M CH3COOH dodajamo po 1,0 ml 0.1M NaOH tako, da dodamo skupno 20,0 ml raztopine NaOH! Kdisoc.=1.8x10-5 CH3COOH + NaOH → CH3COONa + H2O 47 1. Koliko g NH4Cl moramo dodati k 500 mL raztopine s c (NH3) = 0,1 mol/L, da dobimo raztopino s pH =9 ? (Spremembo volumna zanemarimo!) Kb= 1,8.10-5 Rešitev : 4,81g soli 2. Izračunaj pH in [H3O+] , če zmešamo 22mL raztopine HAc s c (HAc) = 0,1 mol/L in 22 mL raztopine NaOH s c (NaOH) = 0,1 mol/L ! Ka= 1,8.10-5 Rešitev : 8,72 3. Pri kateri pH vrednosti dosežemo ekvivalentno točko, če 10 mL raztopine NH4OH s c (NH4OH) = 0,3 mol/L titriramo z raztopino HCl s c(HCl) =0,3 mol/L ? Kb= 1,79.10-5 Rešitev : 5,04 48 4. Koliko mL NaOH s c (NaOH) = 1mol/L moramo dodati k 100mL CH3COOH s c (CH3COOH) = 1mol/L, da bo pH=5 ? Kk= 1,8.10-5 Rešitev : 64,3 mL 5. Raztopina, ki vsebuje 8,08g NaOH v 2L ima pH=12,9. Izračunaj stopnjo protolize! Rešitev : 0,79 6. HNO2 + H2O → H3O+ + NO2Koncentracija ck = 0,08 mol/L, Kk = 4,5 .10-4. Izračunaj [H3O+] ! Rešitev: [H3O+] = 5,8 .10-3 mol/L 49 Pufrsko raztopino pripravimo tako, da v 250 mL 0,15 M raztopine CH3COOH dodamo 4,95g NaCH3COO pKk = 4,74 a) Izračunaj pH b) Kakšen je pH, če k 100 mL pufrske raztopine dodaš 80 mg NaOH? Katera reakcija poteče? 50 Rešitev pH= pKk + log [CH3COO-] / [CH3COOH] = 4,74 + log 4,95:82/ 0,25x0,15=4,95 v 100ml je : 0,1L .0,15mol/L = 0,015mol kisline; 0,06 mol.100/250=0,024mol soli pH= pKk + log [CH3COO-] / [CH3COOH] = 4,74 + log0,026/0,013=5,04 [CH3COO-] = 0,024 + 0,08g/40 gmol-1=0,026 [CH3COOH] = 0,015 - 0,08/40=0,013 pH = 4,95 pH = 5,04 51 pH raztopin soli/hidroliza/ Ko reagirata ekvimolarni količini HCl in NaOH, pride do reakcije nevtralizacije Raztopine soli, ki nastanejo pri nevtralizaciji močne kisline z močno bazo imajo pH=7. Odstopanja od tega pH kažejo tiste raztopine soli, ki nastanejo pri reakciji šibke kisline z močno bazo. Ekvimolarne količine ocetne kisline in natrijevega hidroksida, reagirajo zaradi reakcije nevtralizacije do natrijevega acetata in vode. pH take raztopine ni nevtralen, ampak pH>7: CH3COOH + NaOH → CH3COO- + Na+ + H2O 52 • To je povezano z dejstvom, da so acetatni ioni kot srednje močna konjugirana baza v ravnotežju z nedisociirano šibko kislino: CH3COO- + H2O → CH3COOH + OHPrehod protonov povzroči povišanje OH- , glede na čisto vodo. Hidratizirani Na+ ioni ne kažejo nobene reakcije z vodo! • Podobno je če reagira močna kislina z šibko bazo. V raztopini je prebitek H3O+ ionov, reagira torej kislo: pH< 7, kar pokaže primer z amonijevim kloridom: NH4+ + H2O → H3O+ + NH3 • Prehod protonov povzroči povišanje H3O+, glede na čisto 53 vodo. Hidratizirani Cl- ioni ne kažejo nobene reakcije z vodo. 54 Pufri in njihovo delovanje Puferske raztopine vsebujejo substance, ki omogočajo da se pri dodatku kisline ali baze, pH raztopine neznatno spremeni. • Pufri so: Mešanica šibke kisline in njene konjugirane baze npr. ocetna kislina/natrijev acetat Mešanica šibke baze in njene konjugirane kisline npr. amoniak/amonijev klorid Kadar govorimo o 0,2M acetatnem pufru, pomeni to da imamo v 1L vodne raztopine pufra: 0,1mol ocetne kisline in 0,1 mol natrijevega acetata. Kaj se zgodi, ko dodamo H3O+ oz. OH- ione? 55 • Ko dodamo H3O+, prevzame acetat protone in tvori nedisociirano ocetno kislino. H3O+ + CH3COO- → CH3COOH + H2O (1) • Ko dodamo OH- ione, odvzamejo le ti ocetni kislini protone, tvorijo pa se acetatni ioni: OH- + CH3COOH → CH3COO- + H2O (2) V obeh primerih nastane nevtralna voda, ki je že prisotna v raztopini. Povišanje koncentracije ene ali druge vrste ionov ne vpliva bistveno na pH! To kar velja za acetatni pufer lahko razširimo na vse puferske raztopine. 56 HIDROLIZA h = nh /n0 stopnja hidrolize je odvisna od temperature [OH-] =√Kh.cs [OH-] =√(Kw/Kk).cs ali [H+] = √ (Kw/Kb).cs PUFRI [H+] = Kk. ck/cs [OH-] = Kb. cb/cs 57 Topnostni produkt Velja za slabo topne a dobro disociirane elektrolite, npr: AgCl. Ravnotežje v heterogenem sistemu: AgCl (s) ⇔ AgCl (aq) Če je snov slabo topna, je koncentracija nasičene raztopine majhna. 58 Lahko predpostavimo, da raztopljena snov popolnoma disociira: AgCl (aq) ⇔ Ag+(aq) + Cl-(aq) AgCl (s) ⇔ Ag+(aq) + Cl-(aq) 59 K= [Ag+] . [Cl-] [AgCl]] Koncentracija AgCl v trdni fazi je konstantna oz. se zelo malo spreminja ⇒ [Ag+ ] ⋅ [ Cl-] = [ K ⋅ AgCl]] = LAgCl LAgCl = (topnostni produkt AgCl ) = 1,8 .10-10 s = [Ag+ ] = [ Cl-] [ mol ion/L] [Ag+] . [Cl-] = s2 s = Lp = (1,8 ×10-10)1/2 = 1,34 ⋅ 10-5 [mol ion/L] 60 PbCl2 ⇔ Pb2+ + 2ClLPbCl2,25°°C = [Pb2+ ] ⋅ [ Cl-]2 = 1,7 ⋅ 10-5 Lp (PbCl2) = s . (2s)2 = 4s3 As2S3 s= 3 1 Lp(PbCl 2 ) 4 ⇔ 2As 3+ +3S2- LAs2S3,25°°C = [As 3+]2 ⋅ [S2-]3 = 4 ⋅10-5 61 Med topnostnim produktom L , K in topnostjo s (konc. nasičene raztopine v mol/L) velja za poljubni elektrolit zveza: AmBn ⇔ nA+m + mB-n s ns ms K=[A+m]n×[B-n]m = (ns)n(ms)m = nnmm sn+m s = (L/ nnmm) 1/(n+m) As2S3 ⇔ 2 As 3+ +3 S 2LAs2S3 = [As 3+]2 ⋅ [S2-]3 = 4 ⋅10-5 = (2.s)2.(3.s)3=108s5 s = (LAs2S3 /108)1/5 = (4 ⋅10-5 /108)1/5 = 5,17× 10-2 mol ion /L 62 Vpliv skupnega iona Na izločanje ali raztapljanje trdnih snovi lahko v skladu z zakonom o vplivu koncentracij vplivamo s spreminjanjem koncentracije enega od ionov. Enačba [Ag+ ] ⋅ [ Cl-] = LAgCl kaže , da se iz nasičene raztopine izloči trdna snov, če je produkt koncentracije obeh vrst ionov - Q večji od topnostnega produkta. 63 Q = L……..sistem je v ravnotežju Q < L……..razt. ni nasičena, oborina se ne izloči, ampak se sol še raztopi dokler ni Q = L Q > L…….izloči se oborina 64 LAgCl = [Ag+ ] ⋅ [ Cl-] = 1,8⋅⋅10-10 [ NaCl ] = [ Cl-] = 0,1mol/L s = [Ag+ ] = LAgCl / [ Cl-] = 1,8 ⋅10-10 /10-1 = 1,8 ⋅10-9 [ mol ion/L] V čisti vodi je topnost AgCl: [Ag+ ] = [Cl-] s = ( LAgCl)1/2 = 1,34 ⋅10-5 [ mol ion/L] 65 Naloge: 1. Računski nalogi: a) Topnostni produkt ........ je ............. . Koliko mg ........... se lahko raztopi v 1 L vode? Koliko mg pa se raztopi v 1 L ........ M .................. ? b) Topnostni produkt .......... je .......... . Izračunaj množinsko koncentracijo (molarnost) nasičene raztopine! Koliko mg ......... se lahko raztopi v 150 L vode? 66 30 mL nasičene raztopine PbCl2⇔ Pb2+ + 2Cl- filtrat I Pb 2+ + 2Cl- dodatek : Na+ + Cl- filtrat II Pb 2+ + 2Cl- dodatek : 2H+ + SO42- 67 PbCl2 + Pb 2+ + 2Cl-+ Na+ filtrat III PbSO 4+ 2H+ + 2Clveč PbSO4 oborine dodatek : 2H+ + SO42- PbSO4+ 2Cl-+ Na++2H+ manj PbSO4 oborine 68 REAKCIJE OKSIDACIJE IN REDUKCIJE Oksidacija pomeni, da je postalo oksidacijsko število bolj pozitivno, element je izgubil nekaj nadzora nad e-. Snov se je oksidirala. Redukcija pomeni, da je postalo oksidacijsko število elementa bolj negativno, element je pridobil nekaj nadzora nad e-. Snov se je reducirala. Oksidanti in reducenti imajo različne redukcijske in oksidacijske lastnosti. Oksidanti povzročijo oksidacijo snovi, s katero reagirajo. Snov, ki se oksidira oddaja eoksidantu. Ker oksidant sprejema e-, to pomeni, da se reducira. 69 Zato so oksidanti akceptorji elektronov. To so običajno: Reaktivne nekovine: t.j. kisik in halogeni Oksospojine, zlasti: npr.kalijev dikromat V kislem mediju: kalijev permanganat Reducenti povzročijo redukcijo snovi, s katero reagirajo. Snov, ki se reducira sprejema e- od reducenta. Ker reducenti oddajajo e-, to pomeni, da se oksidirajo. Zato so reducenti donorji elektronov. To so običajno: Reaktivne kovine: kovine 1. In 2.skupine ter Zn, Fe, Sn; Vodik, ogljik,in ogljikov monoksid Vodikov sulfid in žveplov dioksid 70 1. Elektrokemijska napetostna vrsta za kovine K Ca Mg Zn Fe Sn Pb H Cu Ag Au Elementi levo od vodika izpodrivajo vodik. Elementi desno od vodika ne izpodrivajo vodika iz kislin. Vsak element izpodriva iz spojin vse elemente, ki so desno od njega. Redoksi reakcije potečejo zato, ker elementi, ioni in spojine različno močno vežejo elektrone npr : Zn + 2HCl = H2 + ZnCl2 Vodikov ion močneje privlači elktron, kot cinkov atom, zato pride do reakcije! Zn - e- = Zn 2+ H+ + e- = Ho delne reakcije 71 1. Elektrokemijska napetostna vrsta za kovine Baker močneje veže elektrone kot vodik, zato ga ne izpodriva iz kislin: Cu + 2HCl = ne poteče Cu + CuCl2 = ne poteče Cink slabše veže elektrone kot baker, zato ga izpodriva iz spojin: Zn+ CuCl2 = Cu + ZnCl2 Zno - 2e- = Zn2+ delne reakcije Cu 2+ + 2e- = Cuo Cu + ZnCl2 = ne poteče Zn + ZnCl2= ne poteče 72 Figure 21.2 An oxidation-reduction reaction. A strip of zinc metal was placed in a solution of copper(II) sulfate (left), and the zinc reacts with the copper(II) ions to give copper metal and zinc ions in solution. Zn+ CuCl2 = Cu + ZnCl2 Zn(s) + Cu 2+(aq) → Zn 2+(aq) + Cu(s) Copper metal accumulates on the zinc strip, and the blue color of aqueous 73 copper(II) ions fades as copper(II) ions disappear from solution (middle and right). 2.Napetostna vrsta za nekovine Elementi I.skupine P.S. so močni reducenti. Halogeni pa so močni oksidanti. NaBr + Cl2 + H2O → NaCl + Br2 + H2O Br2 se raztaplja v CCl4 (rjava barva dokaz Br2 ) KJ + Cl2 + H2O → KCl + J2 + H2O J2 se raztaplja v CCl4 (vijolična barva dokaz za J2 ) Napetostna vrsta za nekovine: F Cl Br J S 74 3. Kalijev manganat (VII) kot oksidant v različnih medijih: KMnO4 + H2SO4 + Na2SO3 → Na2SO4 + K2SO4 + H2O + MnSO4 Mn7+ + 5e- = Mn 2+ S4+ - 2e- = S6+ x2 x5 KMnO4 + H2O + Na2SO3 → MnO2 + KOH + Na2SO4 Mn 7+ + 3e- = Mn 4+ x2 S4+ -2e= S6+ x3 KMnO4 + NaOH + Na2SO3 → K2SO4 + H2O + Na2MnO4 Mn7+ + 1eS4+ - 2e- = Mn6+ = S6+ x2 x1 75 4. Določevanje Fe 2+ s titracijo z 0,02M KMnO4 KMnO4 + H2SO4 + FeSO4 → Fe2(SO4)3 + K2SO4 + H2O + MnSO4 Mn 7+ + 5e2Fe 2+ - 2e- = Mn 2+ / x2 = 2Fe 3+ / x5 76 Reakcije HNO3 in H2SO4 z nekaterimi polžlahtnimi kovinami: HNO3 (razr.) + Cu → Cu(NO3)2 + NO + H2O HNO3 (konc.) + Cu → Cu(NO3)2 + NO2 + H2O Enako velja za: Ag, Hg, Cr, Co in Ni ! H2SO4 + Cu → CuSO4 + SO2 + H2O Aktivne kovine in HNO3 Zn + HNO3 → Zn(NO3)2 + H2 77 Žlahtne kovine in HNO3 Au + HNO3 + 3HCl → AuCl3 + NO + H2O 78 Naloge: 1. Računska naloga Izračnajte, koliko mililitrov ....... HNO3 z gostoto ...... g/mL potrebujete za raztapljanje ........ g ......! Izračunajte tudi, koliko litrov in kateri plin pri reakciji nastane pri temperaturi ..... °C in tlaku ...... kPa! 79