Naloge za preverjanje znanja pred 2. kontrolno nalogo – 2. letnik
Transcription
Naloge za preverjanje znanja pred 2. kontrolno nalogo – 2. letnik
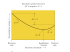
Naloge za preverjanje znanja pred 2. kontrolno nalogo – 2. letnik Šolsko leto 2014/2015 RAVNOTEŽJE, RAVNOTEŽJA V VODNIH RAZTOPINAH ELEKTROLITOV 1. Dopolnite kemijsko enačbo in jo uredite. SO3(g) ⇌ SO2(g) + _____ (g) a) V posodo damo 2 mol žveplovega trioksida. Po določenem času se vzpostavi ravnotežje. V ravnotežni mešanici je 1,52 mol žveplovega trioksida. Kolikšni sta množini žveplovega dioksida in kisika v tej ravnotežni zmesi? b) Izračunajte ravnotežno konstanto danega ravnotežja, če je prostornina posode 2 L. c) Od česa je odvisna vrednost ravnotežne konstante za določeno reakcijo? 2. Zapišite urejeno kemijsko enačbo za reakcijo sinteze amoniaka iz elementov. V enačbi označite, da gre za ravnotežno reakcijo. _______________________________________________________ Opisana reakcija je eksotermna. Po določenem času se v reakcijski zmesi vzpostavi ravnotežje. Kako bi na položaj ravnotežja vplivalo zvišanje temperature reakcijske zmesi? _________________________ Kako bi na položaj ravnotežja vplivalo znižanje tlaka reakcijske zmesi? ________________________________ V katero smer bi se pomaknilo ravnotežje, če bi iz reakcijske zmesi odstranili nekaj amoniaka? ____________ 3. Razvrstite naslednje raztopine po naraščajoči bazičnosti (1 najmanj bazična, 6 najbolj bazična): - limonin sok mleko kava jabolčni kis 2 M NaOH raztopina pralnega praška _____ _____ _____ _____ _____ _____ 4. Kako bi lahko vplivali na ravnotežje spodnje reakcije, da bi dobili čim več produktov? 2 NO2 ( g ) N 2 O4 ( g ) H r 57kJ 5. Zapišite protolitsko reakcijo amoniaka v vodi s pripadajočimi agregatnimi stanji. Pod enačbo označite, kaj je v enačbi po Brǿnsted-Lowryjevi teoriji kislina, baza in kaj konjugirana kislina, konjugirana baza? 1 Naloge za preverjanje znanja pred 2. kontrolno nalogo – 2. letnik Šolsko leto 2014/2015 6. Z oksidacijskimi števili posameznega elementa v spojini si pomagamo pri poimenovanju spojin. a) S pomočjo oksidacijskih števil poimenujte naslednje spojine: KMnO4 Na2SO3 NaClO3 H2CO3 b) S kemijsko formulo zapišite naslednje spojine: - 7. srebrov(I) nitrat (V) fosforjeva (V) kislina dušikov(IV) oksid bakrov(II) hidroksid ________________ ________________ ________________ ________________ Pri kateri reakciji reagira voda kot kislina? Zapišite enačbo izbrane protolitske reakcije. A B C Č D NH4+ HNO3 R-NH2 HCOOH HClO4 + H2O + H2O + H2O + H2O + H2O 8. Obkrožite trditve, ki veljajo za klorovodikovo kislino. a b c č d 9. Klorovodikova kislina je vodna raztopina plina vodikovega klorida. Slabo prevaja električni tok. Z bazami tvori soli. Lakmus se v klorovodikovi kislini obarva modro. V klorovodikovi kislini je veliko oksonijevih kationov in kloridnih anionov, molekul HCl v raztopini ni. Izračunajte pH 0,01 M raztopine barijevega hidroksida. Predpostavite popolno disociacijo. Zapišite enačbo elektrolitske disociacije. 10. pH raztopine je enak 3,5. Kolikšna je koncentracija oksonijevih ionov v raztopini? 11. V 1,75 L raztopine se nahaja 2,50 ·1021 hidroksidnih ionov. Izračunajte pH in pOH. 2 Naloge za preverjanje znanja pred 2. kontrolno nalogo – 2. letnik Šolsko leto 2014/2015 12. 250 mL plinastega vodikovega klorida, merjenega pri normalnih pogojih, raztopimo v vodi, da dobimo 600 mL raztopine. Izračunajte pH nastale raztopine. 13. Mravljična ali metanojska kislina (HCOOH) je šibka organska kislina, vrednost konstante te kisline pri temperaturi 25 °C je 1,8 10-4. Kolikšen je pH 0,2 M raztopine metanojske kisline? Zapišite enačbo protolize: _____________________________________________ 14. 80 mL vodne raztopine s pH = 13 razredčite na 800 mL. Kolikšen je pH razredčene raztopine? 15. Pri nevtralizaciji 200 mililitrov 0,2 M raztopine HCl z 0,1 M raztopino KOH dobimo tipično titracijsko (nevtralizacijsko) krivuljo. a) Skicirajte potek titracijske (nevtralizacijske) krivulje in označite ekvivalentno točko. b) Koliko ml baze moramo dodati klorovodikovi kislini, da dosežemo ekvivalentno (nevtralizacijsko) točko? 16. Ob formulah navedenih kislin, baz in soli dopišite njihova imena. Obkrožite snov, katere vodna raztopina je šibka kislina. A B C Č D E F NH3(aq) HClO3(aq) HCOOH(aq) H2SO4(aq) H3PO3(aq) Ca3(PO4)2(aq) NaHCO3(aq) __________________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ __________________________________________________ 3 Naloge za preverjanje znanja pred 2. kontrolno nalogo – 2. letnik Šolsko leto 2014/2015 17. Katera snov tvori pri raztapljanju v vodi kislo raztopino? Razložite zakaj? A B C Č D KCH3COO KHSO4 KOH KCl KNO3 18. Zmešate raztopini dveh elektrolitov. V katerem primeru poteče ionska reakcija? A B C Č E kalijev klorid in kalijev nitrat(V) natrijev sulfat(VI) in barijev klorid natrijev karbonat in kalijev sulfat(VI) natrijev nitrat(V) in kalijev jodid natrijev fosfat(V) in kalijev nitrat(V) 19. Napišite produkte ionskih reakcij, jih uredite in označite agregatna stanja. Če reakcija ne poteče, napišite /. a) KCl(aq) + b) H3PO4(aq) c) NaI(aq) AgNO3(aq) + + KOH(aq) KCl(aq) č) CaCO3(aq) + HCl(aq) d) K2SO4(aq) + Ba(OH)2(aq) e) AgNO3(aq) + NaCl(aq) f) NaCN(aq) + HCl(aq) 4 Naloge za preverjanje znanja pred 2. kontrolno nalogo – 2. letnik Šolsko leto 2014/2015 REŠITVE: 1. 2 SO3(g) ⇌ 2 SO2(g) + O2 (g) a) n(SO2) = 0,48 mol 2. 3 H2 n(O2) = 0,24 mol b) Kc = 0,0120 c) od temperature + N2 ⇌ 2 NH3 Kako bi na položaj ravnotežja vplivalo zvišanje temperature reakcijske zmesi? pomik v levo Kako bi na položaj ravnotežja vplivalo znižanje tlaka reakcijske zmesi? pomik v levo V katero smer bi se pomaknilo ravnotežje, če bi iz reakcijske zmesi odstranili nekaj amoniaka? pomik v desno 3. 1, 4, 3, 2, 6, 5 4. nižja temperatura, višji tlak, dodajanje NO2 , odvzemanje N2O4 5. NH3 (g) + baza 6. a) kalijev manganat(VII) natrijev sulfat(IV) natrijev klorat(V) ogljikova kislina b) ⇌ NH4+ (aq) + konj. kislina H2O (l) kislina OH- (aq) konj. baza AgNO3 H3PO4 N 2O Cu(OH)2 7. C 8. a, c, d 9. Ba(OH)2 10. c (H3O+) = 3,16 · 10-4 M 11. pOH = 2,38 12. pH = 1,73 13. HCOOH + 14. pH = 12 15. b) Ba2+ + 2 OH- pH = 12,3 pH = 11,62 H2O ⇌ HCOO- + V (KOH) = 400 mL 5 H3O+ pH = 2,22 Naloge za preverjanje znanja pred 2. kontrolno nalogo – 2. letnik Šolsko leto 2014/2015 16. A B C Č D E F vodna raztopina amonijaka klorova(V) kislina metanojska kislina žveplova(VI) kislina fosforjeva(III) kislina kalcijev fosfat(V) natrijev hidrogenkarbonat 17. B, ker je hidrogensulfat(VI) in lahko odda še en proton molekuli vode 18. B 19. a) KCl(aq) b) H3PO4(aq) c) NaI(aq) č) CaCO3(aq) + 2 HCl(aq) d) K2SO4(aq) + e) AgNO3(aq) + NaCl(aq) AgCl (s) + NaNO3(aq) f) NaCN(aq) HCN (g) + NaCl (aq) + AgNO3(aq) + 3 KOH(aq) + KCl(aq) + AgCl (s) + KNO3(aq) + 3 H2O (l) ne poteče CO2(g) + CaCl2 (aq) + H2O (l) Ba(OH)2(aq) HCl(aq) K3PO4(aq) 6 BaSO4(s) + 2 KOH (aq)