Flyer - Rheumatologische Fortbildungsakademie
Transcription
Flyer - Rheumatologische Fortbildungsakademie
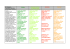
2009 Köln Vorprogramm 23. bis 26. September 2009 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. 23. Jahrestagung der Assoziation für Orthopädische Rheumatologie e.V. (ARO) 19. Jahrestagung der Gesellschaft für Kinder- und Jugendrheumatologie (GKJR) Inhalt GRUSSWORT WISSENSCHAFTLICHE LEITUNG en ach 5 Jahr n t n 1 ie t a P Jeder 5. mission e R r ie e r ittelf in arzneim 04 UND ORGANISATION 05 WISSENSCHAFTLICHES PROGRAMM 08 RHEUMAAKADEMIE-KURSE 12 SATELLITENSYMPOSIEN 13 SPONSOREN 14 ALLGEMEINE HINWEISE 15 INDUSTRIEAUSSTELLUNG 20 R AHMENPROGRAMM 22 TOURISTISCHES R AHMENPROGRAMM 23 NOTIZEN 24 REMIC ADE® i. v. schnell – stark – bewähr t 3 Schnelle und anhaltende Entzündungskontrolle 3 Starker Schutz vor Gelenkzerstörung 3 Weltweit über 1.000.000 behandelte Patienten 2, 3 4, 5 6 1. Bei Rheumatoider Arthritis. Klarenbeek NB et al. THU0162, EULAR 2008, 2. Shergy WJ et al. J Rheumatol. 2002; 29: 667–677, 3. Quinn MA et al. Arthritis Rheum 2005; 52:27-35, 4. Aktuelle Fachinformation, 5. Smolen JS et al. Arthritis Rheum 2006; 54: 702-710, 6. Data on File PSUR (Nr. 18) - Essex Pharma GmbH, Centocor B.V. In allen Indikationen gemeinsam: Rheumatoide Arthritis, Ankylosierende Spondylitis, Psoriasis-Arthritis, Plaque-Psoriasis, Morbus Crohn, Päd. Morbus Crohn, Colitis ulcerosa © Stadt Köln | Günther Ventur Pflichttext siehe Seite 26 Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. 3 Grußwort Wissenschaftliche Leitung und Organisation LIEBE KOLLEGINNEN, LIEBE KOLLEGEN, LIEBE FREUNDE INTERESSIERTE IN DER RHEUMATOLOGIE, Veranstaltungsort UND KÖLNKONGRESS GMBH wir möchten Sie herzlich zur 37. Jahrestagung der Deutschen Gesellschaft für Rheumatologie gemeinsam mit der 19. Jahrestagung der Gesellschaft für Kinder- und Jugendrheumatologie und der 23. Jahrestagung der Assoziation für Orthopädische Rheumatologie im September 2009 in Köln einladen. Das Motto des Kongresses lautet „Innovation und Zukunft in der Rheumatologie“ – hat doch die Rheumatologie wie kaum ein anderes Fach therapeutische Neuerungen in den letzten Jahren erlebt. Die Zukunft der Rheumatologie sehen wir in der optimierten Vernetzung der rheumatologischen Disziplinen untereinander wie auch mit den anderen Fachbereichen der Medizin, insbesondere der Dermatologie, Nephrologie, Kardiologie, Pulmonologie, Osteologie und der Schmerztherapie. Die Rheumatologie hat in den letzten zehn Jahren erheblich an Profil gewonnen und ist klinisch und wissenschaftlich Meilen vorangekommen. Mit dem Programm des Kongresses wollen wir die klinisch tätigen Kollegen ansprechen und die Kollegen einbeziehen, die aktiv die Grundlagenforschung in Immunologie und Rheumatologie vorantreiben. Ziel ist, damit die Basis für ein besseres Verständnis der Pathogenese und somit der Behandlung chronisch entzündlicher Erkrankungen zu schaffen. In bewährter und noch optimierter Weise wird der Kongress in „Tracks“ ausgerichtet, um konkurrierende Symposien zu vermeiden und die Interessen der verschiedenen Zielgruppen besser zu berücksichtigen. Innovative Kongressbeiträge werden in diesem Jahr besonders gewürdigt: In „3 slides in 3 minutes“-Vorträgen sollen ausgewählte Abstracts präsentiert und anschließend diskutiert werden. Dieses neue Konzept bringt Abwechslung auf unseren Kongress und fordert Autor und Publikum. Noch ein kurzer Ausblick auf das Begleitprogramm: Am Eröffnungsabend treffen wir uns in den Rheinterrassen und genießen den Blick auf den Dom und die historische Altstadt. Der Gesellschaftsabend findet im traditionsreichen Gürzenich statt, der vor allem durch den Kölner Karneval berühmt wurde. Wir freuen uns auf Ihr Kommen und hoffen auf wissenschaftlich interessante, spannende und kommunikative Tage. Congress-Centrum Ost Messeplatz 1, 50679 Köln Tel. +49 (0) 221 821-3212, Fax +49 (0) 221 821-3430 www.koelnkongress.de Kongresstermin 23. – 26. September 2009 Kongresspräsidenten PD DR. ANDREA RUBBERT Universitätsklinik Köln Medizinische Klinik I Josef Stelzmannstr. 9, 50924 Köln Tel. +49 (0)221 4783993 [email protected] PROF. DR. GERD HORNEFF Asklepios Klinik Sankt Augustin Arnold Janssen Str. 29, 53757 Sankt Augustin Tel. +49 (0)2249 249 200, Fax +49 (0)2249 249 203 [email protected] PROF. DR. HANS-WOLFRAM NEUMANN Orthopädische Universitätsklinik Universitätsklinikum Magdeburg A.ö.R. Leipziger Str. 44, 39120 Magdeburg Tel. +49 (0) 391 6714000, Fax +49 (0) 391 6714006 [email protected] Veranstalter der wissenschaftlichen Tagung Mit Grüßen aus Köln und St. Augustin PD Dr. Andrea Rubbert-Roth Kongresspräsidentin DGRh DEUTSCHE GESELLSCHAFT Prof. Dr. Gerd Horneff Kongresspräsident GKJR Prof. Dr. Wolfram Neumann Kongresspräsident ARO FÜR RHEUMATOLOGIE E. V. Luisenstr. 41, 10117 Berlin, Tel. +49 (0)30 2404 8470, Fax +49 (0)30 2404 8479 [email protected], www.dgrh.de GESELLSCHAFT FÜR KINDER- UND JUGENDRHEUMATOLOGIE C / O D EUTSCHES R HEUMA -FORSCHUNGSZENTRUM Charitéplatz 1, 10117 Berlin, Tel. +49 (0)30 28460 632, Fax +49 (0)30 28460 626, www.gkjr.de A SSOZIATION RHEUMAORTHOPÄDIE C/O GESCHÄFTSSTELLE DER ARO Frau Simone Rehart, Nachtigallenweg 5, 65929 Frankfurt/M., www.orthopaedische-rheumatologie.de Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. 5 Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. © Stadt Köln | Inge Decker 4 T- IT EL HE W U E N 6 Wissenschaftliche Leitung und Organisation Neu bei Rheumatoider Arthritis N A C H T- C O R T I C O I D Veranstalter der Fachausstellung und der zertifizierten Fortbildungskurse halbiert die Morgensteifigkeit 1) RHEUMATOLOGISCHE FORTBILDUNGSAKADEMIE GMBH Luisenstr. 41, 10117 Berlin Tel. +49 (0) 30 24048473 Fax +49 (0) 30 24048479 [email protected] Kongressorganisation und Veranstalter des Rahmenprogramms – Anmeldung zum Kongress und weitere Informationen KONGRESS- UND MESSEBÜRO LENTZSCH GMBH Seifgrundstr. 2, 61348 Bad Homburg Tel. +49 (0) 6172 6796-0 Fax +49 (0) 6172 6796-26 [email protected] Wissenschaftliches Programmkomitee Prof. Dr. Peter Herzer Dr. Rieke Alten Prof. Dr. Hans-Iko Huppertz Prof. Dr. Christoph Baerwald Prof. Dr. Joachim R. Kalden Prof. Dr. Jürgen Braun Dr. Thomas Karger Prof. Dr. Harald Burkhardt Prof. Dr. Gerd-Rüdiger Burmester PD Dr. Peter Kern Prof. Dr. Gernot Keyßer Prof. Dr. Günther Dannecker Prof. Dr. Ina Kötter PD Dr. Karl-Stefan Delank Dr. Jasmin Kümmerle-Deschner PD Dr. Oliver Distler Prof. Dr. Hanns-Martin Lorenz Dr. Edmund Edelmann Prof. Dr. Bernhard Manger Ursula Faubel Prof. Dr. Elisabeth Märker-Hermann PD Dr. Dirk Föll Prof. Dr. Wilfried Mau Prof. Dr. Steffen Gay Prof. Dr. Ulf Müller-Ladner Prof. Dr. Ekkehard Genth Prof. Dr. Hubert Nüßlein Prof. Dr. Wolfgang L. Gross PD Dr. Benedikt C. Ostendorf PD Dr. Thomas Pauly Prof. Dr. Andreas Radbruch Prof. Dr. Stefan Rehart Prof. Dr. Wolfgang Rüther Prof. Dr. Georg Schett Prof. Dr. Klaus Schmidt Prof. Dr. Matthias Schneider Prof. Dr. Hendrik Schulze-Koops Prof. Dr. Joachim Sieper Prof. Dr. Christof Specker Dr. Jörg Wendler Prof. Dr. Angela Zink Anmeldung von Beiträgen Die Anmeldung von Beiträgen erfolgt für den 37. Kongress ausschließlich per Internet unter www.dgrh.de/abstracts2009.html Weitere Hinweise zum Procedere finden Sie unter www.dgrh.de/abstracts2009regeln.html Einsendeschluss für Abstracts ist der 30. April 2009 Es wird darauf hingewiesen, dass erstmals freie Beiträge in 3 Veranstaltungen am Donnerstag und Freitag als kurze Vorträge präsentiert werden. Diese werden aus allen angenommenen Posterbeiträgen ausgewählt. Der Autor soll die Highlights seiner Arbeit kurz und knapp mit 3 Slides in 3 Minuten vorstellen und diskutieren. Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. Nacht-Corticoid: Wirkt schon vor dem ersten Hahnenschrei Die patentierte TEMPUS-Tablette sorgt bei abendlicher Einnahme für die Wirkstoff-Freisetzung zum physiologisch optimalen Zeitpunkt am frühen Morgen. Bezeichnung: Lodotra® 1/2/5mg, Tabletten mit veränderter Wirkstofffreisetzung. Wirkstoff: Prednison. Pharmazeutischer Unternehmer: Nitec Pharma GmbH; Joseph-Meyer-Str. 13-15, 68167 Mannheim. Vertrieb in Deutschland: Merck Pharma GmbH, Alsfelder Straße 17, 64289 Darmstadt. Zusammensetzung: Arzneilich wirksamer Bestandteil: 1 Tablette mit veränd. Wirkstofffreisetzung enth. 1/2/5mg Prednison. Sonstige Bestandteile: Hochdisperses Siliciumdioxid, CroscarmelloseNatrium, Lactose-Monohydrat, Magnesiumstearat (Ph. Eur.). Povidon K 29/32, Eisen(III)-oxid, E 172.: Calciumhydrogenphosphat Dihydrat, Glyceroldibehenat (Ph. Eur.), Eisen(III)-hydroxid-oxid x H2O. Anwendungsgebiete: Z. Behandl. d. mäßigen bis schw. akut. rheumatoiden Arthritis b. Erw. insb. wenn v. morgendl. Gelenksteifigkeit begleitet. Gegenanzeigen: Überempf. geg. Prednison o. sonst. Bestandteile. Warnhinweise u. Vorsichtsmaßnahmen: Aufgrund d. verzög. Wirkstofffreisetzung b. Beibehaltg des gleichen Therapieschemas nicht durch Prednison-Tabl. mit sofortiger Wirkstofffreisetzung ersetzen. Aufgrund seiner pharmakolog. Eigenschaft. nicht bei akut. Indikat. anstelle v. Prednison-Tabl. m. sofort. Wirkstofffreisetzung anwenden. Enth. Lactosemonohydrat. Schwangerschaft u. Stillzeit: Anwend. i. d. Schwangersch. nur, wenn zu erwart. Vorteile mögl. Risiken überwiegen. Bei Dosen > 10mg/Tag wird empfohlen, Stillen einzustellen. Nebenwirkungen: Häufig: Mittelgradige Leukozytose, Lymphopenie, Eosinopenie, 1) Fachinformation Lodotra®, April 2009 Merck Pharma GmbH Postfach 100133, 64201 Darmstadt Tel. 0180-2227600 Fax +496151-62859816 [email protected] Mehr zu Lodotra® und Rheumatoider Arthritis auch auf dem neuen Ärzteportal www.medquarter.de Polyzythämie. Schwächung d. Immunabwehr, Maskierung v. Infektionen, Exazerbation latenter Infektionen. Adrenale Suppression u. Induktion eines CushingSyndroms, Natriumretention m. Ödembildung, erhöhte Kaliumausscheidung, gesteig. Appetit u. Gewichtszunahme, verring. Glukosetoleranz, Diabetes mellitus, Hypercholesterinämie u. Hypertriglyzeridämie. Schlaflosigkeit, Kopfschmerzen, Katarakt, insb. m. subkapsulärer Trübung hinten; Glaukom, Striae rubrae, Atrophie, Teleangiektasien, erhöhte Kapillarfragilität, Petechien, Ekchymosen, Muskelatrophie u. Schwächegefühl, Osteoporose. Gelegentlich: Hypertonie, erhöhtes Arterioskleroseu. Thromboserisiko, Vaskulitis, gastrointestinale Ulzera, gastroint. Blutungen, Hypertrichose, Steroidakne, verzög. Wundheilung, Rosacea-ähnliche (periorale) Dermatitis, Veränderungen d. Hautpigmentierung. Selten: Allerg. Reaktionen, Störung d. Ausschüttung v. Sexualhormonen, Störung d. Schilddrüsenfunkt., Depression, Reizbarkeit, Euphorie, erhöhter Antrieb, Psychose, Pseudotumor cerebri, Manifestation einer latent. Epilepsie u. erhöh. Anfallsneigung bei manifester Epilepsie, Verschlechterung d. Symptomatik verbunden m. Hornhautulzera; Begünstigung v. Virus-, Pilz- u. bakt. Entzündungen d. Auges, Pankreatitis, Überempfindlichkeitsreakt., z. B. Arzneimittelexanthem, asept. Osteonekrose. Nähere Angaben siehe Gebrauchs- u. Fachinformation. Verschreibungspflichtig. Stand: April 2009. www.lodotra.de Wissenschaftliches Programm Wissenschaftliches Programm Donnerstag | 24.09.2009 Freitag | 25.09.2009 07.00 – 07.45 Uhr Frühstücksgespräche – Rheumaakademie 07.00 – 07.45 Uhr Frühstücksgespräche – Rheumaakademie 08.00 – 09.30 Uhr Abstracts – Presidential Selection 08.00 – 09.30 Uhr Biologica – Safety Update 10.00 – 11.30 Uhr Pathogenese des SLE 10.00 – 11.30 Uhr Off-Label Therapie in der Rheumatologie Fibromyalgie Seltene genetische Erkrankungen in der Rheumatologie (im Kindes- und Erwachsenenalter) Evidence based therapy in Rheumatic Diseases Vermeidbare Fehler in der Rheumatologie Neues zur Bildgebung AGRZ-Kampagne: Der informierte Patient als Partner Entzündliche ZNS-Erkrankungen Ernährung 3 x 3 (3 Slides in 3 Minutes) Abstract Präsentationen – Basic Sciences Cartilage regeneration and repair 3 x 3 (3 Slides in 3 Minutes) Abstract Präsentationen – Klinische Rheumatologie Start-Up Projekte 2008 3 x 3 (3 Slides in 3 Minutes) Abstract Präsentationen – Interdisziplinär 11.30 – 14.00 Uhr Posterpräsentation 12.30 – 14.00 Uhr Satellitensymposien Bristol Myers Squibb | Essex | Pfizer | Roche 14.15 – 15.45 Uhr Rheumatoide Arthritis 11.30 – 14.00 Uhr Posterpräsentation 12.30 – 14.00 Uhr Satellitensymposien Abbott | Chugai/Roche | Merck | UCB 14.15 – 15.45 Uhr Systemischer Lupus Erythematodes (SLE) Infektionen und Autoimmunität Falsche Konzepte in der Medizin – der Missbrauch von Sprache und Zahlen Rheumazentren stellen sich vor: Bremen, Leipzig Partnerland Türkei: Was können wir voneinander lernen? Spondyloarthritiden interdisziplinär Schmerzmanagement in der Rheumatologie – Der unspezifische Rückenschmerz Arzneimittelsicherheit in pädiatrischer und Erwachsenen-Rheumatologie MicroRNAs in immunology and rheumatic disease Vernetzung der Rehabilitation in der rheumatologischen Versorgung Pathogenesis of JIA – what have we learned? Besonderheiten der Rheumaorthopädie Visions for regenerative rheumatology Krankheit und Kommunikation – Medizin und Medien 16.15 – 17.45 Uhr Remission als Ziel Kollagenosen – Interdisziplinäre Aspekte bei Sjögren-Syndrom und Myositis 16.15 – 17.45 Uhr Satellitensymposien Actelion Pharmaceuticals | AMGEN | Essex | medac | MSD | Pfizer | Sanofi-Aventis Interdisziplinärer Dialog internistische – orthopädische Rheumatologie Versorgungsrealität in der Rheumatologie an der Schnittstelle zwischen Innovations- und Kostendruck Neue Entwicklungen in Labordiagnostik rheumatischer Krankheiten Cellular culprits and targets JIA: Biologika aktuell Ellenbogendestruktion bei rheumatoider Arthritis Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. 9 Freitag | 25. September 2009 Donnerstag | 24. September 2009 8 Samstag | 26. September 2009 10 Wissenschaftliches Programm Samstag | 26.09.2009 07.00 – 07.45 Uhr Frühstücksgespräche – Rheumaakademie 08.00 – 09.30 Uhr A year in a review Komplikationen rheumatischer Erkrankungen Die Degeneration des Hüftgelenks bei chronischer Polyarthritis (Oberflächenersatz – Kurzschaft – Probleme) Epigenetics and inflammatory disease 08.00 – 16.00 Uhr Workshops – Rheumaakademie 10.00 – 14.00 Uhr Patiententag – Deutsche Rheuma-Liga Podiumsdiskussion zur Versorgungslage Arztvorträge Arztsprechstunde 10.00 – 11.30 Uhr Systemische Sklerose: Pathophysiologie und aktuelle therapeutische Konzepte „ Ob ich noch tanze? Klar. ... gestern ... heute ... und morgen natürlich auch! “ Experimental therapies – from bench to bedside Versorgungsstrategien am entzündlich rheumatischen Sprunggelenk Cellular communication in rheumatic diseases 12.00 – 13.30 Uhr Behandlungsoptionen bei Therapie-refraktärer Vaskulitis CSI-Fallbesprechungen Osteoporose – ein Update Genetics 14.00 – 15.30 Uhr Summary Session & Posterpreisverleihung Knochenstoffwechsel bei rheumatoiden Erkrankungen Rheumaorthopädie in der Ära nach der Einführung der Biologicals? Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. Behandeln Sie heute für morgen Humira® 40 mg Injektionslösung in Fertigspritze/Humira 40 mg Injektionslösung im vorgefüllten Pen (Injektor, vorgefüllt/FertigPEN). Wirkstoff: Adalimumab. Zusammensetzung: Jede Einzeldosis-Fertigspritze à 0,8 ml enthält 40 mg Adalimumab; jede Einzeldosis à 0,8 ml des vorgefüllten Pens enthält 40 mg Adalimumab (rekombinanter humaner monoklonaler Antikörper, der in Ovarialzellen des Chinesischen Hamsters exprimiert wird). Sonstige Bestandteile: Mannitol (Ph. Eur.), Citronensäure-Monohydrat, Natriumcitrat, Natriumdihydrogenphosphat-Dihydrat, Natriummonohydrogenphosphat-Dihydrat, Natriumchlorid, Polysorbat 80, Natriumhydroxid, Wasser für Injektionszwecke. Anwendungsgebiete: Rheumatoide Arthritis: Humira ist in Kombination mit Methotrexat indiziert: – Zur Behandlung der mäßigen bis schweren aktiven rheumatoiden Arthritis bei erwachsenen Patienten, die nur unzureichend auf krankheitsmodifizierende Antirheumatika einschließlich Methotrexat angesprochen haben. – Zur Behandlung der schweren, aktiven und progressiven rheumatoiden Arthritis bei Erwachsenen, die zuvor nicht mit Methotrexat behandelt worden sind. Humira kann im Falle einer Unverträglichkeit gegen Methotrexat, oder wenn die weitere Behandlung mit Methotrexat nicht sinnvoll ist, als Monotherapie angewendet werden. Humira verhindert in Kombination mit Methotrexat das Fortschreiten der radiologisch nachweisbaren strukturellen Gelenkschädigungen und verbessert die körperliche Funktionsfähigkeit. Polyartikuläre juvenile idiopathische Arthritis: Humira ist in Kombination mit Methotrexat indiziert zur Behandlung der aktiven polyartikulären juvenilen idiopathischen Arthritis bei Jugendlichen im Alter von 13 bis 17 Jahren, die nur unzureichend auf ein oder mehrere krankheitsmodifizierende Antirheumatika (DMARDs) angesprochen haben. Humira kann im Falle einer Unverträglichkeit gegenüber Methotrexat, oder wenn die weitere Behandlung mit Methotrexat nicht sinnvoll ist, als Monotherapie angewendet werden. Psoriasis-Arthritis: Humira ist indiziert zur Behandlung der aktiven und progressiven Psoriasis-Arthritis (Arthritis psoriatica) bei Erwachsenen, die nur unzureichend auf eine vorherige Basistherapie angesprochen haben. Humira reduziert das Fortschreiten der radiologisch nachweisbaren strukturellen Schädigungen der peripheren Gelenke bei Patienten mit polyartikulären symmetrischen Subtypen der Erkrankung und verbessert die körperliche Funktionsfähigkeit. Ankylosierende Spondylitis: Humira ist indiziert zur Behandlung der schweren und aktiven ankylosierenden Spondylitis bei Erwachsenen, die nur unzureichend auf eine konventionelle Therapie angesprochen haben. Morbus Crohn: Humira ist indiziert zur Behandlung eines schwergradigen, aktiven Morbus Crohn bei Patienten, die trotz einer vollständigen und adäquaten Therapie mit einem Glukokortikoid und/oder einem Immunsuppressivum nicht ausreichend angesprochen haben und/oder die eine Unverträglichkeit gegen eine solche Therapie haben oder bei denen eine solche Therapie kontraindiziert ist. Während der Induktionsbehandlung sollte Humira in Kombination mit Glukokortikoiden verabreicht werden. Im Falle einer Unverträglichkeit gegen Glukokortikoide, oder wenn eine weitere Behandlung mit Glukokortikoiden nicht sinnvoll ist, kann Humira auch als Monotherapie verabreicht werden. Psoriasis: Humira ist indiziert zur Behandlung der mittelschweren bis schweren chronischen Plaque-Psoriasis bei erwachsenen Patienten, die auf eine andere systemische Therapie, wie Cyclosporin, Methotrexat oder PUVA, nicht angesprochen haben oder bei denen eine Kontraindikation oder Unverträglichkeit einer solchen Therapie vorliegt. Gegenanzeigen: Überempfindlichkeit gegenüber dem Wirkstoff oder einem der sonstigen Bestandteile. Aktive Tuberkulose oder andere schwere Infektionen wie Sepsis und opportunistische Infektionen. Mäßige bis schwere Herzinsuffizienz (NYHA Klasse III/IV). Nebenwirkungen: Klinische Studien: Die Inzidenzen sind definiert als: sehr häufig ë 1/10, häufig ë 1/100 < 1/10, gelegentlich ë 1/1.000 < 1/100, selten ë 1/10.000 < 1/1.000. Sehr häufig: Reaktion an der Injektionsstelle (einschl. Schmerz, Schwellung, Rötung oder Pruritus). Häufig: Infektionen des unteren Respirationstraktes (einschl. Pneumonie, Bronchitis), Virusinfektionen (einschl. Influenza, Herpesinfektionen), Candidiasis, bakterielle Infektionen (einschl. Harnwegsinfektionen), Infektionen der oberen Atemwege, Benommenheit (einschl. Schwindel), Kopfschmerzen, neurologische Empfindungsstörungen (einschl. Parästhesien), Husten, nasopharyngealer Schmerz, Diarrhoe, Abdominalschmerzen, Stomatitis und Mundulzeration, Übelkeit, Erhöhung der Leberenzyme, Hautausschlag, Pruritus, muskuloskelettale Schmerzen, Fieber, Müdigkeit/Abgeschlagenheit (einschl. Asthenie und Unwohlsein). Gelegentlich: opportunistische Infektionen (einschl. Tuberkulose, Histoplasmose), Sepsis, Abszess, Gelenkinfektion, Hautinfektion (einschl. Weichteilinfektion und Impetigo), oberflächliche Pilzinfektionen (einschl. Haut, Nagel, Fuß), Hautpapillom, Neutropenie (einschl. Agranulozytose), Leukopenie, Thrombozytopenie, Anämie, Lymphadenopathie, Leukozytose, Lymphopenie, systemischer Lupus erythematodes, Angioödem, Arzneimittelüberempfindlichkeit, Hypokaliämie, erhöhte Blutfettwerte, Appetitstörungen (einschl. Anorexie), Hyperurikämie, Stimmungsschwankungen, Ängstlichkeit (einschl. Nervosität und Agitation), Synkope, Migräne, Tremor, Schlafstörungen, Störungen des Sehvermögens, Empfindungsstörungen der Augen, Infektion, Reizung oder Entzündung des Auges, Ohrbeschwerden (einschl. Schmerz und Schwellung), Arrhythmie, Tachykardie, Blutdruckerhöhung, Flush, Hämatome, Asthma, Dyspnoe, Dysphonie, nasale Kongestion, rektale Blutung, Erbrechen, Dyspepsie, abdominale Blähungen, Verstopfung, Urtikaria, Psoriasis, Ekchymose und vermehrt Blutergüsse, Purpura, Dermatitis, Ekzem, Haarausfall, Hämaturie, eingeschränkte Nierenfunktion, Blasen- und Harnröhrenbeschwerden, Störungen des Menstruationszyklus und Blutungsstörungen, Brustschmerzen, Ödeme, Grippe-ähnliche Symptome, Erhöhung der Kreatinphosphokinase im Blut,Verlängerung der partiellen Thromboplastinzeit, Nachweis von Autoantikörpern, versehentliche Verletzung, beeinträchtigte Wundheilung. Selten: nekrotisierende Fasciitis, virale Meningitis, Divertikulitis, Wundinfektion, Lymphom, solide Organtumoren (einschl. Brust, Eierstock, Hoden), malignes Melanom, Plattenepithelkarzinome der Haut, Panzytopenie, idiopathische thrombozytopenische Purpura, Serumkrankheit, saisonale Allergie, Schilddrüsenfunktionsstörung (einschl. Struma), Hyperkalzämie, Hypokalzämie, multiple Sklerose, Gesichtslähmung, Panophthalmie, Iritis, Glaukom, Hörverlust,Tinnitus, Herzstillstand, Insuffizienz der Koronararterien,Angina pectoris, Perikarderguss, dekompensierte Herzinsuffizienz, Herzklopfen, Gefäßverschluss, Aortenstenose, Thrombophlebitis, Aortenaneurysma, Lungenödem, pharyngeales Ödem, Pleuraerguss, Pleuritis, Pankreatitis, intestinale Stenose, Kolitis, Enteritis, Oesophagitis, Gastritis, Lebernekrose, Hepatitis, Leberverfettung, Cholelithiasis, erhöhtes Bilirubin im Blut, Erythema multiforme, Pannikulitis, Rhabdomyolyse, Proteinurie, Nierenschmerzen. Unerwünschte Ereignisse nach Markteinführung und aus klinischen Studien der Phase IV: Darmwandperforation; Reaktivierung einer Hepatitis B; demyelinisierende Erkrankungen (z.B. Optikusneuritis, Guillain-Barré-Syndrom); interstitielle Lungenerkrankung, einschl. Lungenfibrose; kutane Vaskulitis; anaphylaktische Reaktion; hepatosplenales T-Zell-Lymphom. Verschreibungspflichtig. Pharmazeutischer Unternehmer: Abbott Laboratories Ltd., Queenborough, Kent ME11 5EL, Vereinigtes Königreich Stand: August 2008 12 Rheumaakademie-Kurse Satellitensymposien Donnerstag | 24.09.2009 Donnerstag | 24.09.2009 FRÜHSTÜCKSGESPRÄCHE LUNCHSYMPOSIEN 07.00 – 07.45 Uhr Rheuma & Impfungen: FSME, Hepatitis B 12.30 – 14.00 Uhr Chugai/Roche Zytokine im internistischen Netzwerk Physikalische Therapie 1 Merck Neues aus der Welt der Glucocorticoide Blickdiagnose (mit TED) UCB Neue Biologika: Was ist für den Arzt und den Patienten relevant? Abbott Arbeitstitel liegt noch nicht vor. Rheuma und Alter Freitag | 25.09.2009 FRÜHSTÜCKSGESPRÄCHE NACHMITTAGSSYMPOSIEN 07.00 – 07.45 Uhr Familienplanung & Schwangerschaft 16.15 – 17.45 Uhr MSD Arbeitstitel liegt noch nicht vor. Arzneimittelinteraktion medac Methotrexat – wie optimieren Sie die Therapie? Physikalische Therapie 2 AMGEN Neueste Aspekte des Knochenstoffwechsels Lyme-Arthritis – a never ending story (mit TED) Essex 10 Jahre TNFα-Blockade in Deutschland Störungen des Lipidstoffwechels – was muss der Rheumatologe wissen? Pfizer Schmerz in der Rheumatologie: Was geht mich das an? Actelion Pharmaceuticals Systemische Sklerose in der Praxis – Die Bedeutung der dualen EndothelinRezeptor-Blockade Sanofi-Aventis Bewährte Strategien mit DMARDs – Erfahrungen aus der Praxis Essex Neue Therapieoptionen bei Rheumatoider Arthritis, Anklyosierender Spondylitis und Psoriasis-Arthritis Bristol Myers Squibb T-Zell-gerichtete Therapie in der RA: Frühzeitig langfristig denken Roche B-Zell-Therapie 360 Grad Pfizer Klinische Rheumatologie und pharmakologische Grundlagen vom Molekül zur Kasuistik Samstag | 26.09.2009 FRÜHSTÜCKSGESPRÄCHE 07.00 – 07.45 Uhr Genetische Fiebersyndrome Notfälle in der Rheumatologie Physikalische Therapie 3 RA – Wann wem welches Medikament? Freitag | 25.09.2009 LUNCHSYMPOSIEN WORKSHOPS 12.30 – 14.00 Uhr 08.00 – 16.00 Uhr Labormedizinische Diagnostik rheumatischer Krankheiten 2 08.00 – 16.00 Uhr Physikalische Medizin, Hilfsmittel & Rehabilitation 08.00 – 12.00 Uhr Kapillarmikroskopie 2 Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. 13 14 Sponsoren Allgemeine Hinweise Platinsponsor Roche Pharma AG D-79639 Grenzach-Wyhlen Chugai Pharma Ltd. D-60528 Frankfurt/Main Hinweise für Referenten Alle eingeladenen Referenten werden gebeten, eine Kurzfassung ihres Vortrags als Abstract bis zum 10. August 2009 online unter www.dgrh.de/abstracts2009.html einzureichen. Vorträge müssen grundsätzlich als digitale Präsentation auf CD-ROM oder USB-Stick eine Stunde vor Vortragsbeginn in der Medienannahme abgegeben werden. In allen Sitzungsräumen stehen Beamer zur Verfügung. Ein eigener Laptop kann nicht installiert werden. Ausschließliches Präsentationsformat ist Microsoft Power Point (ab Version 97) für Windows. Bitte beachten Sie die Inkompatibilität zwischen Apple-Macintosh und dem Windows-Betriebssystem! Video-Clips müssen in die abgegebene Datei integriert sein. Sollten Sie weitere Tagungstechnik benötigen, wenden Sie sich bitte an das Kongress- und MesseBüro Lentzsch. Goldsponsor Essex Pharma GmbH D-81737 München Bristol-Myers Squibb GmbH & Co. KGaA D-80636 München UCB GmbH D-40789 Monheim Merck Pharma GmbH D-64289 Darmstadt Um den Zeitplan einhalten zu können, werden die Referenten gebeten, die vorgegebene Redezeit nicht zu überschreiten. Hinweis für die Posterpräsentation Die Posterpräsentationen finden am Donnerstag und Freitag in der Zeit von 11.30 – 14.00 Uhr statt. Die Autoren verpflichten sich, während dieser Zeit anwesend zu sein. In der Posterdebatte soll in einem 2-minütigen Vortrag die vorgestellte Kernaussage des Posters präsentiert und anschließend diskutiert werden. Bitte bringen Sie Ihr Poster am Tag Ihrer Posterpräsentation bis 09.00 Uhr an und nehmen Sie es zwischen 16.00 und 18.00 Uhr wieder ab. Die Kongressorganisation ist nicht verantwortlich für nicht abgenommene Poster. Klebematerial für die Poster wird zur Verfügung gestellt. Für jedes Poster steht eine Fläche von 0,98 m Breite x 2,00 m Höhe zur Verfügung. Das Poster soll auf einer rechteckigen Fläche von jeweils 0,90 x 1,50 m im Hochformat präsentiert werden. Eine DIN-A4-Verkleinerung oder Kurzfassung sollte zur Mitnahme ausgelegt werden. Die besten Poster werden am Samstag, 26.09.2009 um 14.00 Uhr in der Summary Session prämiert. Silbersponsor Abbott GmbH & Co. KG D-67061 Ludwigshafen Pfizer Pharma GmbH D-10785 Berlin Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. 15 16 Allgemeine Hinweise Kongresshomepage DGRh: www.dgrh.de GKJR: www.agkjr.de ARO: www.orthopaedische-rheumatologie.de Auf diesen Internet-Homepages stehen das aktuelle Programm und sämtliche Informationen immer auf dem neuesten Stand für Sie zur Verfügung. Detaillierte Informationen zu den Akademiekursen finden Sie auf der Seite www.rheumaakademie.de der Rheumatologischen Fortbildungsakademie. Kongresssprachen Deutsch, Englisch (Forum Experimentelle Rheumatologie) Es erfolgt keine Simultanübersetzung. Zertifizierung Die Veranstaltung wird von der Landesärztekammer Nordrhein und von der Rheumatologischen Fortbildungsakademie zertifiziert. Es werden 5 CME-Punkte pro Tag vergeben. Für einige Satellitensymposien erfolgt eine gesonderte Zertifizierung, dabei können zusätzliche CME-Punkte erworben werden. Öffnungszeiten Registrierungscounter Mittwoch, 23. September 2009 Donnerstag, 24. September 2009 Freitag, 25. September 2009 Samstag, 26. September 2009 14.00 – 20.00 Uhr 07.00 – 18.00 Uhr 07.00 – 18.00 Uhr 07.00 – 16.00 Uhr Unterkunft Eine Aufstellung von Hotels mit Zimmerkontingenten zum Kongress finden Sie unter www.dgrh.de. Buchungen können direkt bei den Hotels unter dem Stichwort „Rheumakongress“ vorgenommen werden. Sollten Sie andere Unterkünfte wünschen, ist Ihnen KÖLNTOURISMUS GMBH Brought to you from the makers of REMICADE® Wir setzen den erfolgreichen Weg fort und forschen für neue Anti-TNF-Therapieoptionen verschiedene Applikationsformen und neue Dosierungsintervalle in den Indikationen RA, AS, PsA Kardinal-Höffner-Platz 1 50667 Köln Tel. +49 (0) 221 221-304 00 Fax +49 (0) 221 221-304 10 [email protected] gerne behilflich. Online-Anmeldung Die Anmeldungen zum Kongress erbitten wir über die Internet-Seite www.dgrh.de. Dort steht ein Online-Anmeldeformular zur Verfügung. Sollte Ihnen kein Internetzugang zur Verfügung stehen, wenden Sie sich bitte an das Kongress- und MesseBüro Lentzsch. Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. &TTFY1IBSNB(NC)t5IPNBT%FIMFS4USBFt.àODIFO%FVUTDIMBOE .FEJDBM*OGPSNBUJPOTDJFOUJmDJOGPSNBUJPO!FTTFYEF 18 Allgemeine Hinweise Allgemeine Hinweise Anmeldegebühren bei Anmeldung und Zahlung bis zum 30.06.2009 Mitglieder der DGRh, ARO, GKJR (inkl. Referenten) 130,00 € Nichtmitglieder 155,00 € Assistenzärzte 65,00 € Studenten 25,00 € Tageskarte 80,00 € Begleitpersonen 30,00 € Anmeldebestätigung Eine schriftliche Bestätigung Ihrer Anmeldung erhalten Sie nach Zahlungseingang. bei Anmeldung und Zahlung bis zum 21.09.2009 Mitglieder der DGRh, ARO, GKJR (inkl. Referenten) 145,00 € Nichtmitglieder 170,00 € Assistenzärzte 80,00 € Studenten 35,00 € Tageskarte 80,00 € Begleitpersonen 45,00 € Teilnahmebestätigung Die Teilnahmebestätigung für die Tagung erhalten Sie nach Unterschrift am Registrierungscounter. bei Anmeldung und Zahlung ab dem 22.09.2009 Mitglieder der DGRh, ARO, GKJR (inkl. Referenten) Nichtmitglieder Assistenzärzte Studenten Tageskarte Begleitpersonen Kongressunterlagen Ihr Namensschild sowie die bestellten Karten für das Tagungs- und Rahmenprogramm werden Ihnen zusammen mit der Anmeldebestätigung nach Zahlungseingang zugeschickt. Bitte bringen Sie diese Unterlagen mit nach Köln. Ihre Kongressmappe liegt am Registrierungscounter für Sie bereit. Nachrichten Eine Nachrichtenhinterlegung ist am Kongresscounter möglich. Stornierung Bei der schriftlichen Stornierung Ihrer Tagungsteilnahme vor dem 20.08.2009 werden 26,00 € pro Person Stornierungs- bzw. Bearbeitungsgebühren berechnet. Nach dem 20.08.2009 ist eine Rückzahlung der Teilnehmergebühren nicht mehr möglich. Bei Stornierung Ihrer Anmeldung zum Rahmenprogramm bis zum 20.08.2009 wird eine Stornierungsund Bearbeitungsgebühr in Höhe von 15,00 € pro Person und gebuchter Veranstaltung erhoben. Nach diesem Datum verfallen die Teilnehmerkarten bei Nichtinanspruchnahme. Maßgeblich für die Einhaltung der Fristen ist der Eingangsstempel der Kongress- und MesseBüro Lentzsch GmbH. 180,00 € 210,00 € 100,00 € 50,00 € 100,00 € 60,00 € Für die Gewährung der reduzierten Teilnehmergebühren ist dem Anmeldeformular eine gültige Bescheinigung des leitenden Arztes oder der Universität beizulegen. Die Gebühr für Kongressteilnehmer beinhaltet die Kongressunterlagen mit dem Abstractband, den Zutritt zu den wissenschaftlichen Veranstaltungen und zur Industrieausstellung sowie zur Kongresseröffnung. Die Gebühren für den Gesellschaftsabend und das Rahmenprogramm finden Sie auf dem Anmeldeformular. In der Gebühr für die Begleitpersonen ist die Teilnahme an der Kongresseröffnung eingeschlossen. Für Begleitpersonen gelten in Bezug auf das Rahmenprogramm und den Gesellschaftsabend dieselben Bedingungen wie für Kongressteilnehmer. Zusätzliche Gebühren Für den Besuch der Akademie-Workshops am Samstag, den 26.09.2009 werden gesonderte Gebühren erhoben: – Labormedizinische Diagnostik rheumatischer Krankheiten 2 – Kapillarmikroskopie 2 – Physikalische Medizin, Hilfsmittel & Rehabilitation 40,00 € 40,00 € 40,00 € Die Gebühren sind ein Kongresssonderpreis, da diese konsentierten curricularen Weiterbildungen in diesem Rahmen pilotiert werden. Die Teilnehmerzahl ist begrenzt. Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. Haftung Die Kongress- und MesseBüro Lentzsch GmbH tritt in jedem Falle nur als Vermittler auf und haftet nicht für Verluste, Unfälle oder Schäden an Personen und Sachen, gleich welchen Ursprungs. Die Haftung der mit den Fahrten beauftragten Personen und Unternehmen bleibt hiervon unberührt. An allen Ausflügen, Touren usw. beteiligt sich der Reisende auf eigene Gefahr. Mündliche Nebenabsprachen sind unverbindlich, sofern sie nicht schriftlich bestätigt werden. Zahlungshinweise Zahlungsmöglichkeiten – per Bank-Überweisung unter Angabe Ihres Namens auf folgende Bankverbindung: Kongress- und MesseBüro Lentzsch GmbH Deutsche Bank PG AG BLZ: 500 700 24 Konto Nr.: 09 383 6508 IBAN: DE49 5007 0024 0093 8365 08 BIC: DEUTDEDBFRA – während des Kongresses mit EC-Karte, Kreditkarte (Master- oder Visacard) oder bar Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. 19 20 Industrieausstellung 24. September 2009 Einladung Industrieausstellung Parallel zum wissenschaftlichen Programm findet in der Messehalle mit direktem Zugang zum Kongresshaus von Donnerstag, 24. September bis Samstag, 26. September 2009, eine Fachausstellung der pharmazeutischen und medizinisch-technischen Industrie statt. Sie gibt einen umfassenden Überblick über neue Produkte und bietet die Möglichkeit, sich intensiv über den aktuellen Stand der Produktentwicklung im diagnostischen und therapeutischen Bereich zu informieren. Veranstalter RHEUMATOLOGISCHE FORTBILDUNGSAKADEMIE GMBH Luisenstr. 41, 10117 Berlin Tel. +49 (0) 30 24048473 Fax +49 (0) 30 24048479 [email protected] Organisation KONGRESS- UND MESSEBÜRO LENTZSCH GMBH Seifgrundstraße 2 61348 Bad Homburg Tel. +49 (0) 6172 6796-0 Fax +49 (0) 6172 6796-26 [email protected] Öffnungszeiten 24. September 2009 25. September 2009 26. September 2009 Evolution in 09.00 – 18.00 Uhr 09.00 – 18.00 Uhr 09.00 – 14.00 Uhr der anti-inflammatorischen Forschung UCB Satelliten Symposium Neue Biologika: Was ist für den Arzt und den Patienten relevant ? Chair: Professor Dr. Burmester, Charité Berlin DGRh 2009, Köln · 12.30 –14.00 Uhr Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. 22 Rahmenprogramm Rahmenprogramm Touristisches Rahmenprogramm Touristisches Rahmenprogramm Treffpunkt für alle Touren ist der Kongress-Registrierungscounter, KölnKongress Ost, Messeplatz 1 KONGRESSERÖFFNUNG Mittwoch, 23. September 2009, 18.00 Uhr Tanzbrunnen Köln, Deutz-Mülheimer Str. 30, 50679 Köln Mit freundlicher Unterstützung GET-TOGETHER-PARTY Donnerstag, 24. September 2009 10.00 – 12.00 Uhr Stadtrundgang „Köln im Überblick“ Kosten 10,00 € pro Person Mindesteilnehmerzahl 10 Personen 13.30 – 15.00 Uhr 1-Stündige Panoramafahrt auf dem Rhein „Köln von seiner schönsten Seite“ Kosten 12,00 € pro Person 14.00 – 16.30 Uhr Hexen, Huren, Heilige: Stadtrundgang zur Kölner Frauengeschichte Kosten 15,00 € pro Person Mindesteilnehmerzahl 10 Personen Mittwoch, 23. September 2009, ab 20.00 Uhr Tanzbrunnen Köln, Deutz-Mülheimer Str. 30, 50679 Köln FUN RUN Freitag, 25. September 2009, 07.00 – 08.00 Uhr 5 km-Lauf GESELLSCHAFTSABEND Freitag, 25. September 2009, 20.00 Uhr Gürzenich Köln, Martinstraße 29 – 37, 50667 Köln Kosten pro Person 30,00 € Bustransfer ab Dorint Hotel und Radisson SAS Gebaut wurde der Gürzenich in den Jahren ab 1441 bis 1447 und hatte von Anfang an die Funktion eines städtischen Festhauses für verschiedenste Veranstaltungen. Zu prächtigen Empfängen luden hier schon 1474 die Kaiser Friedrich III. und 1486 Maximilian I. Letzerer hielt hier 1505 einen Reichstag ab. Freitag, 25. September 2009 09.00 – 17.00 Uhr Bustour: vom Rheintal in die Vulkaneifel Kosten 70,00 € pro Person inkl. Mittagessen in der Vulkanbrauerei Mindesteilnehmerzahl 10 Personen 10.00 – 12.30 Uhr Führung im Römisch-Germanischen Museum und Praetorium Kosten 20,00 € pro Person inkl. Museumseintritt Mindesteilnehmerzahl 10 Personen 14.00 – 16.30 Uhr Stadtrundgang: Histörchen, Originale und Spezialitäten Kosten 15,00 € pro Person Mindesteilnehmerzahl 10 Personen 20.00 – 22.00 Uhr Abendessen mit Ehrungen ab 22.00 Uhr Party mit „Köbes Underground“ Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. Samstag, 26. September 2009 10.00 – 12.00 Uhr Stadtrundgang „Köln im Überblick“ Kosten 10,00 € pro Person Mindesteilnehmerzahl 10 Personen Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. 23 24 Notizen Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. Notizen Vorprogramm | 37. Kongress der Deutschen Gesellschaft für Rheumatologie e.V. 25 REMICADE® 100 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung. Wirkstoff: Infliximab. Zusammensetzung: 1 Durchstechfl. enth. Arzneil. wirks. Bestandt.: 100 mg Infliximab. Sonst. Bestandt.: Saccharose, Polysorbat 80, Dinatriumhydrogenphosphat, Natriumdihydrogenphosphat. Anwendungsgebiete: Rheumatoide Arthritis: In Komb. m. Methotrexat Redukt. d. Symptomatik u. Verbesser. d. körperl. Funktionsfähigk. b. Pat. m. aktiver Erkrank., d. nur unzureich. auf krankheitsmodfizierende Präp., einschl. Methotrexat, angesprochen haben u. b. Methotrexat-naiven Pat. od. Pat., d. nicht m. and. DMARDs vorbehandelt wurden, m. schwergradiger, aktiver u. fortschreitender Erkrank. B. diesen Pat. wurde anhand v. radiolog. Untersuch. Redukt. d. Progressionsrate d. Gelenkschäden nachgewiesen. Morbus Crohn: Behandl. eines schwergradigen, aktiven Morb. Crohn. Erw.: Pat., d. trotz einer vollständ. u. adäquaten Ther. m. einem Kortikosteroid u./o. einem Immunsuppress. nicht angesprochen haben od. b. Unverträglichk. od. Kontraindikationen f. solche Ther.. Behandl. v. aktivem Morb. Crohn m. Fistelbildung b. Pat., d. trotz vollständ. u. adäqu. Ther. m. einer konvent. Behandl. (einschl. Antibiotika, Drainage u. immunsuppr. Ther.) nicht angesprochen haben. Kdr. (6-17 J.): Pat., d. nicht auf eine konvent. Ther. einschließl. Kortikosteroid, Immunmodulator u. primärer Ernährungsther. angesprochen haben od. b. Unverträglichk. od. Kontraindikationen f. solche Ther. REMICADE® wurde bei Kdr. nur in Komb. mit einer konvent. immunsuppress. Ther. untersucht. Colitis ulcerosa: B. mittelschwerer bis schwerer aktiver Colitis ulcerosa b. Pat., d. auf eine konvent. Ther., einschl. Kortikosteroide u. 6-MP od. AZA, unzureich. angesprochen haben, od. b. Unverträglichkeit od. Kontraindikationen f. solche Ther. Ankylosierende y Spondylitis: p y B. schwerwiegender, aktiver ankylosierender Spondylitis bei erw. Pat., die auf eine konvent. Ther. unzureichend angesprochen haben. Psoriasis-Arthritis: B. aktiver u. fortschreitender Psoriasis-Arthritis b. Erw., wenn deren Ansprechen auf eine vorhergehende krankheitsmodifizierende, antirheumat. Arzneimittelther. unzureichend gewesen ist. Verabreichung in Komb. m. Methotrexat od. als Monother. b. Pat., die eine Unverträglichkeit geg. Methotrexat zeigen od. b. denen Methotrexat kontraind. ist. Psoriasis: B. mittelschwerer bis schwerer Plaque-Psoriasis b. Erw., d. auf eine andere system. Ther. (einschl. Ciclosporin, Methotrexat od. PUVA)) nicht angesprochen g p haben,, b. denen eine solche kontraind. ist od. nicht vertragen g wird. Kontraindikationen: Tuberkulose od. and. schwere Infekt. wie Sepsis, Abszesse u. opportunist. Infekt., Überempfindl. geg. d. Wirkstoff od. sonst. Bestandt. d. Produkts od. geg. murine Proteine, mäßiggradige od. schwere Herzinsuff. (NYHA Klasse III/IV). Warnhinweise und Vorsichtsmaßnahmen für die Anwendung: Akute infusionsbed. Reakt. (selten schwerw. allerg. Reakt.), einschl. anaphylakt. Reakt. können während (innerhalb v. Sek.) od. innerhalb v. wenigen Std. nach d. Infusion auftreten. Es können sich Antikörper geg. Infliximab entwickeln, die mit einer erhöhten Häufigkeit für Infusionsreakt. in Zusammenhang gebracht wurden. Pat., d. Immunsupressiva vor od. während d. Behandl. m. REMICADE® absetzen,, haben ein höheres Risiko,, Antikörper p geg. g g den Wirkstoff zu bilden. B. Auftreten v. schweren Reakt. dürfen keine weiteren REMICADE®-Inf. erfolgen. Verfügbare Daten deuten auf ein erhöhtes Risiko f. eine verzögerte Überempfindlichkeit m. zunehmender Ther.pause hin. Die Anw. v. REMICADE® b. Pat. m. chronischen Infekt. bzw. m. einer Anamnese v. rezidivierenden Infekt., od. m. begleitender immunsuppressiver Medikation, ist sorgfältig zu erwägen. Es ist zu beachten, dass d. Blockade d. TNFD d. Symptome einer Infekt. wie z.B. Fieber maskieren kann. Hinsichtl. einer aktiven od. inaktiven („latenten”) Tuberkulose sind vor d. Behandl. eine detaillierte Anamnese u. geeignete Untersuchungen, d.h. Tuberkulinhauttest u. Thoraxröntgenaufnahme, durchzuführen. Falls eine inaktive („latente”) Tuberkulose diagnostiziert wird, so muss eine Behandl. d. latenten Tuberkulose m. einer Anti-Tuberkulose-Ther. vor d. Verabreichung v. REMICADE® eingeleitet werden. B. Pat. m. Morb. Crohn m. Fistelbildung u. akut eitrigen Fisteln darf die Ther. erst nach Ausschluss einer mögl. Infektionsquelle (insbes. Abszess) eingeleitet werden. Pat. mit Risiko für eine HBV-Inf. sollten vor Beginn einer Ther. mit REMICADE® auf HBV untersucht werden. Hep. B Dauerträger während u. bis mehrere Monate nach Ende der REMICADE®-Behandl. überwachen. Bei HBV-Reaktivierung Ther.abbruch u. Einleitung einer antiviralen Therapie. Pat. m. Symptomen od. Anzeichen einer Leberfunktionsstörung sollten auf Hinw. einer Leberschädigung untersucht werden. Falls sich ein Ikterus u./od. ALT-Erhöhungen um mind. das Fünffache d. oberen Normalwertes entwickeln, sollte REMICADE® abgesetzt werden. D. Komb. v. REMICADE® u. Anakinra wird nicht empfohlen. Lebendimpfstoffe sollten nicht gleichzeitig mit REMICADE® verabreicht werden. Pädiatr. Morb. Crohn Pat. möglichst vor Ther.beginn gemäß Impfempfehl. impfen. Tritt in seltenen Fällen ein Lupus-ähnliches Syndrom auf od. weisen Blutuntersuchungen (pos. Antikörper-Befund gegen Doppelstrang-DNS) auf ein mögl. Auftreten hin, ist d. REMICADE®-Behandl. abzubrechen. B. Pat. m. vorbest. od. kürzl. aufgetretenen demyelinis. Erkrank. d. ZNS muss das Nutzen-Risiko-Verhältnis vor d. REMICADE®-Behandl. sorgfältig abgewogen werden. Vorsicht b. Pat. m. malignen Erkr. in d. Vorgeschichte, b. Pat. mit erhöhtem Risiko f. mal. Erkr. infolge starken Rauchens od. bei Pat., d. eine mal. Erkr. entwickeln u. weiterbehandelt werden sollen, b. Pat. m. Psoriasis u. extensiver immunsuppressiver Ther. od. längerfristiger PUVA-Behandl. in d. Vorgeschichte. Nach d. Markteinführung wurden seltene Fälle v. sehr agressiven u. meist tödlich verlaufenden hepatosplenalen T-Zell-Lymphomen b. adoleszenten u. jungen erw. Pat. m. Morb. Crohn, d. m. REMICADE® u. gleichzeitig Azathioprin od. 6 Mercaptopurin (6-MP) behandelt wurden, beschrieben. B. Pat. m. Colitis ulcerosa, d. ein erhöhtes Risiko f. eine Dysplasie od. ein Kolonkarzinom haben od. die in d. Vorgeschichte eine Dysplasie od. ein Kolonkarzinom aufweisen, sollten Untersuchungen (einschl. Koloskopie u. Biopsien) vor d. Ther. u. während d. Krankheitsverlaufs in regelm. Intervallen auf Dysplasien durchgeführt werden. Pat. m. leichter Herzinsuffizienz sind genau zu überwachen. B. d. Entwickl. v. neuen od. sich verschlechternden Symptom en d. Herzinsuffizienz ist d. Behandl. abzubrechen. Vorsicht b. geplanten Operationen od. zahnärztlichen Behandl. Schwangerschaft und Stillzeit: REMICADE® darf nicht in d. Schwangersch. u. Stillz. angew. werden. Eine adäqu. Methode zur Empfängnisverhütung ist während d. Behandl. u. über 6 Mon. nach d. letzten Infusion durchzuführen. Mind. 6 Mon. nach d. letzten Infusion dürfen Frauen nicht stillen. Besondere Patientengruppen: Außer b. Morb. Crohn wird REMICADE® nicht zur Anw. b. Kdr. <18 Jahren empfohlen aufgrund v. unzureichenden Daten zur Sicherheit u. Wirksamkeit. Spez. Unters. m. REMICADE® b. älteren Pat. od. b. Pat. m. Leber- od. Nierenerkr. sind nicht durchgeführt worden. Nebenwirkungen: Häufig: g Virusinfekt. (z. B. Influenza, Herpes), Serumkrankheit-ähnliche Reakt., Kopfschmerzen, Schwindel/Benommenheit, / , Erröten,, Infekt. d. unteren Respirationstrakts p (z.B. ( Bronchitis,, Pneumonie),), Infekt. d. oberen Respirationstrakts, p , Sinusitis,, Dyspnoe, y p , Abdominalschmerzen, Diarrhoe, Übelkeit, Dyspepsie, erhöhte Transaminasen, Urtikaria, Hautausschlag, Pruritus, Hyperhidrose, Hauttrockenheit, infusionsbedingte Reakt., thorakale Schmerzen, Ermüdung, Fieber. Gelegentlich: g Sepsis, Tuberkulose, Abszess, bakterielle Infektion, Pilzinfektion, Cellulitis, Candidose, Neutropenie, Leukopenie, Thrombozytopenie, Anämie, Lymphopenie, Lymphadenopathie, Lymphozytose, anaphylaktische Reakt., Lupus-ähnliches Syndrom, allergische g Reakt. d. Respirationstrakts, p , Depression, p , Amnesie,, Agitation, g , Verwirrtheit,, Schlaflosigkeit, g , Somnolenz,, Nervosität,, Apathie, p , demyelinisierende y Erkrankung (MS-artige Erkrankungen) d. ZNS, Endophthalmitis, Keratitis, Konjunktivitis, periorbitales Ödem, Hordeolum, Verschlimmerung einer Herzinsuffizienz, Arrhythmie, Synkope, Bradykardie, Zyanose, Herzklopfen, Hypotonie, periphere Ischämie, Hypertonie, Thrombophlebitis, Hämatom, Ekchymose, Petechien, Gefäßspasmus, Hitzewallungen, Lungenödem, Bronchospasmus, Pleuritis, Epistaxis, Divertikulitis, gastroösophagealer Reflux, Obstipation, Cheilitis, Cholezystitis, Leberfunktionsstörung, Blasenbildung, Furunkulose, Mykosen d. Haut/Onychomykose, Ekzem, Seborrhoe, Rosacea, Hautpapillome, Hyperkeratose,, Alopezie, p , Pigmentanomalie, g , Arthralgie, g , Myalgie, y g , Rückenschmerzen,, Pyelonephritis, y p , Harnwegsinfektion, g Vaginitis, verzög. Wundheilung, Reakt. a. d. Injektionsstelle, Frösteln, Ödem, Schmerzen, Nachweis v. Auto-AK, Störungen d. Komplementsystems. Selten: Meningitis, Tachykardie, Kreislaufversagen, Pleuraerguss, armwandperforation, gastrointest. Hämorrhagie, Darmstenose, Hepatitis, granulomatöse Läsion. Unbekannt: Opportunist. Infektionen (wie Infekt. mit atypischen Mykobakterien, Pneumocystose, Histoplasmose, Coccidioidomykose, Kryptokokkose, Aspergillose u. Listeriose), Reaktivierung einer Hepatitis B, Salmonellose, hepatosplenale T-Zell-Lymphome (bei adolesz. Pat. u. jungen Erw. mit M. Crohn), Lymphome (einschl. Non-Hodgkin- u. HodgkinLymphome), Agranulozytose, thrombot.-thrombozytop. Purpura, Panzytopenie, hämolytische Anämie, idiopath. thrombozytop. Purpura, anaphyl. Schock, Serumkrankheit, Vaskulitis, periph. demyelinisierende Erkr. (z.B. Guillain-Barré Syndrom, chron. entzündl. demyelinisierende Polyneuropathie u. multifok. motorische Neuropathie), demyelinisierende Erkr. d. ZNS (z.B. Optikusneuritis), Myelitis transversa, Krampfanfälle, Neuropathien, Hypästhesie, Parästhesie, Herzinsuffizienz, Perikarderguss, interstitielle Lungenerkrankung (einschl. schnell fortschr. Erkr., Lungenfibrose u. Pneumonitis), Pankreatitis, Leberversagen, Autoimmunhepatitis, Leberzellschaden, Ikterus, toxisch epidermale Nekrolyse, Stevens-Johnson-Syndrom, Psoriasis (einschl. d. Neuauftretens u. pustul. Formen (primär palmar/plantar)), Erythema multiforme. NW können bis zu sechs Monate nach d. letzten Infusion auftreten. Weitere Symptome für NW können sein: Anschwellen d. Füße u. Knöchel, Probleme b. Wasserlassen, Sehen v. Doppelbildern, Schwächegefühl in Armen od. Beinen. Folgende NW traten häufiger bei pädiatr. Pat. mit Morb. Crohn in d. REACH-Studie auf als bei erw. M.-Crohn-Pat.: Anämie, Blut im Stuhl, Leukopenie, Hautrötung, Virusinfekt., Neutropenie, Knochenfrakturen, bakt. Infekt., allerg. Reakt. im Bereich d. Atemwege, Infektionen. Post-marketing-Meld. über schwerw. NW bei päd. Pat. umf. Malignome, einschl. d. hepatospl. T-Zell-Lymphoms, vorübergehende Anorm. d. Leberenzyme, Lupus-ähnliche Syndr. u. pos. Autoantikörper. Verschreibungspflichtig. Weitere Angaben zur sicheren Anwendung des Arzneimittels siehe Fachinformation. Stand der Information: Juni 2008. Pharmazeutischer Unternehmer: Centocor B.V., Einsteinweg 101, 2333 CB Leiden, Niederlande. Repräsentant d. Pharmazeutischen Unternehmers in Deutschland: Essex Pharma GmbH, Thomas-Dehler-Straße 27, 81737 München. ORENCIA® – Nach dem ersten Versagen eines TNF-_-Blockers – denn Zeit ist kostbar bei RA1 < Klinisch bedeutsame Reduktion des DAS28 (_ 1,2) bereits in Monat 22 < Andauernde und sich im Zeitverlauf über 3 Jahre noch verbessernde Wirksamkeit3 < Die einzige T-Zell-gerichtete Therapie, die die Immunantwort frühzeitig moduliert < Studiendaten zu Sicherheit und Verträglichkeit über 5 Jahre4 Referenzen: 1. Schiff M, Zhou X, Kelly S, et al. Efficacy of abatacept in RA patients with an inadequate response to anti - TNF therapy regardless of reason ffor ffailure, or ttype or number therapy used. Ann Rh Rheum Di Dis 2008 2008;67 (Suppll 2) 2):337. 2. S Schiff M, D Dougados M, LLe B Bars M M, ett il b off prior i anti ti - TNF th d A 67 (S 337 | 2 hiff M d M al. Time to treatment response with abatacept in patients with RA and an inadequate response to anti - TNF therapy. Abstract accepted by ACR/ARHP Meeting 2008, San Francisco Oct 24 - 29th 2008;08 - A - 2350 - ACR. | 3. Westhovens R, Luggen M, Russell AS, et al. Abatacept provides durable improvements in RA disease status and a consistent safety profile through 3 years in the AIM and ATTAIN trials. Rheumatology 2008;47(S2):ii46. | 4. Smitten A, Covucci A, Simon T. Descriptive analysis of serious infections, hospitalized infections and malignancies over time in abatacept clinical development program: a safety update with >10,000 person - years of exposure. Ann Rheum Dis 2008; 67:338. ORENCIA® 250 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung. Wirkstoff: Abatacept (humanes Fusionsprotein hergest. in Zellkultur). Zusammensetzung: 1 Durchstechfl. enthält 250 mg Abatacept. Sonstige Bestandteile: Maltose, Natriumdihydrogenphosphat 1 H2O, Natriumchlorid. Anwendungsgebiete: ORENCIA® ist in Kom-bination mit Methotrexat indiziert zur Behandlung der mäßigen bis schweren aktiven Rheumatoiden Arthritis bei Erwachsenen, wenn das Ansprechen auf andere krankheitsmodifizierende Antirheumatika (DMARDs), einschließlich mindestens eines Tumor-Nekrose-Faktor-(TNF)-Inhibitors, nicht ausreichend ist oder wenn diese nicht vertragen werden. Abatacept reduziert in Kombination mit Methotrexat die Progression der Gelenkschädigung und verbessert die körperliche Funktionsfähigkeit. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonst. Bestandteile. Schwere und unkontrollierte Infektionen wie Sepsis und opportunistische Infektionen. Nebenwirkungen: Sehr häufig: Kopfschmerzen; Häufig: Erhöhter Blutdruck, auffällige Leberwerte (einschließlich erhöhter Transaminasen), Benommenheit, Husten, Abdominal-schmerzen, Diarrhöe, Übelkeit, Dyspepsie, Hautausschlag (einschließlich Dermatitis), Infektion der unteren Atemwege (einschließlich Bronchitis), Harnwegsinfekt, Herpes simplex, Infektion der oberen Atemwege (einschließlich Tracheitis, Nasopharyngitis), Rhinitis, Hypertonie, Flushing, Fatigue, Asthenie, Herpes zoster; Gelegentlich: Erniedrigter Blutdruck, Gewichtszunahme, Tachykardie, Bradykardie, Herzklopfen, Thrombozytopenie, Leukopenie, Parästhesie, Konjunktivitis, reduzierte Sehschärfe, Vertigo, g , Gastritis,, Geschwürbildung g im Mundbereich,, aphthöse Stomatitis, erhöhte Neigung zu Blutergüssen, Alopezie, trockene Haut, Arthralgie, Schmerzen merzen in den Gliedmaßen, Zahninfektion, infektiöses Exanthem, Onychomykose, Basalzellkarzinom, Hypotonie, tonie, Hitzewallungen, grippe-ähnliche Beschwerden, Amenorrhoe, Depression, Angstgefühl, Pneumonie, nie, Überempfindlichkeit, Pyelonephritis, Broncho-spasmus, Urtikaria, Psoriasis, Zystitis, Migräne, e, Engegefühl in der Kehle, trockene Augen; Selten: Sepsis, Bakteriämie. Weitere Informationen: n: siehe Fachinformation. Verschreibungspflichtig. Zulassungsinhaber: BRISTOL-MYERS SQUIBB B PHARMA EEIG, Uxbridge Business Park, Sanderson Road, Uxbridge UB8 1DH, UK. Örtlicher er Vertreter in Deutschland: Bristol-Myers Squibb GmbH & Co. KGaA, Arnulfstraße 29, 80636 6 München, Tel. (0 89) 12142-0. Stand: August 2008 Jetzt Neu: RoACTEMRA® Das neue 1st line Biologikum nach DMARD-Versagen bei rheumatoider Arthritis UÊ, /,®ÊÃÌÊÃÃÌiÌÊ V ÜÀÃ>\Ê `ÕÀV ÃV ÌÌV ÊÎä¯ -Ón,iÃà >V ÊÓ{Ê7V i°1–5 UÊ, /,® ÜÀÌÊÃi À ÃV i°1–5 UÊ, /,® ÃÌÊ>ÕV ÊÊ`iÀ Ì iÀ>«iI V ÜÀÃ>°1 UÊ, /,® ÛiÀLiÃÃiÀÌÊ Ã}w>ÌÊ`i iLiõÕ>ÌBÌ Û ,*>ÌiÌi]ÊÃLiÃ`iÀiÊ BiÊÕ`Ê>Ì}Õi°Î]Ê{ *RoACTEMRA® kann in der zugelassenen Indikation als Monotherapie verabreicht werden, falls eine MethotrexatUnverträglichkeit vorliegt oder eine Fortsetzung der Therapie mit Methotrexat unangemessen erscheint. RoActemra®, 20 mg/ml, Konzentrat zur Herstellung einer Infusionslösung. Wirkstoff: Tocilizumab, ein rekombinanter, humanisierter, monoklonaler Antikörper. Zusammensetzung: Jede Durchstechflasche enthält 80 mg in 4 ml, 200 mg in 10 ml bzw. 400 mg in 20 ml (20 mg/ml) Tocilizumab. Sonstige Bestandteile: Sucrose, Polysorbat 80, Dinatriumhydrogenphosphat 12 H2O, Natriumdihydrogenphosphat-Dihydrat und Wasser für Injektionszwecke. Enthält 26,55 mg Natrium pro maximaler Dosis von 1.200 mg (8,85 mg pro 400-mg-Durchstechflasche). Unter kochsalzarmer Diät sollte dies berücksichtigt werden. Dosierungen von weniger als 1.025 mg enthalten weniger als 1 mmol (23 mg) Natrium, d. h., es ist nahezu natriumfrei. Anwendungsgebiete: RoActemra® ist in Kombination mit Methotrexat (MTX) für die Behandlung erwachsener Patienten mit mäßiger bis schwerer aktiver rheumatoider Arthritis (RA) angezeigt, die unzureichend auf eine vorangegangene Behandlung mit einem oder mehreren krankheitsmodifizierenden Antirheumatika (DMARDs) oder Tumornekrosefaktor-(TNF-)Inhibitoren angesprochen oder diese nicht vertragen haben. RoActemra® kann bei diesen Patienten als Monotherapie verabreicht werden, falls eine Methotrexat-Unverträglichkeit vorliegt oder eine Fortsetzung der Therapie mit Methotrexat unangemessen erscheint. Gegenanzeigen: Überempfindlichkeit auf den Wirkstoff oder einen der sonstigen Bestandteile. Aktive, schwere Infektionen. Nebenwirkungen: Infektion des oberen Respirationstrakts, Nasopharyngitis, Zellulitis, Pneumonie, oraler Herpes simplex, Herpes zoster, Mundulzera, Gastritis, Stomatitis, Gastroenteritis, Divertikulitis, Exanthem, Pruritus, Urtikaria, Kopfschmerzen, Schwindel, Erhöhung der Lebertransaminasen, Erhöhung des Gesamtbilirubins, Hypertonie, Leukopenie, Neutropenie, Thrombozytopenie, Hypercholesterinämie, Hypertriglyceridämie, Überempfindlichkeitsreaktion, Konjunktivitis, opportunistische Infekt., Sepsis u. bakt. Arthritis. Schwerw. Infekt. waren selten tödlich Kompl. einer Divertikulitis, wie generalisierte purulente Peritonitis, Perforation des unteren GIT, Fisteln u. Abszesse, Infektionsreaktionen, wie Hypertonie, Kopfschmerzen u. Hautreakt. (Exanthem, Urtikaria), Anzahl der anaphylaktischen Reakt. mit 4 mg/kg-Dosierung mehrfach höher als mit 8 mg/kg-Dosierung. Bildung von Antikörpern geg. Tocilizumab führten teilw. zu med. signifikanter Überempfindlichkeitsreaktion. Arzneimittel für Kinder unzugänglich aufbewahren. Verschreibungspflichtig. Stand: Januar 2009. Bitte Fachinformation beachten. Pharmazeutischer Unternehmer: Roche Registration Limited, Welwyn Garden City, Vereinigtes Königreich. Lokale Ansprechpartner: Roche Pharma AG, 79630 Grenzach-Wyhlen und Chugai Pharma Marketing Ltd., Zweigniederlassung Deutschland, Lyoner Straße 15, 60528 Frankfurt am Main. Quellen: 1 Data on file, F. Hoffmann-La Roche. Research Report No. 1027142. Clinical Stdy Report WA17824 (AMBITION). 2 Data on file, F. Hoffmann-La Roche. Research Report No.1029115. Clinical Study Report WA17823 (LITHE). 3 Data on file, F. HoffmannLa Roche. Clinical Study Report WA17822 (OPTION). 4 Data on file, F. Hoffmann-La Roche. Research Report No. 1025373. Clinical Study Report WA18063 (TOWARD). 5 Data on file, F. Hoffmann-La Roche. Research Report No. 1025583. Clinical Study Report WA18062 (RADIATE).