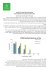השוואת מתן פומי לעישון – THC
Transcription
השוואת מתן פומי לעישון – THC
פרמקוקינטיקה של THCבמתן פומי של מוצרים מבוססי מיצוי קנאביס לעומת עישון קנאביס רפואי
תקציר:
ישנם יתרונות ברורים למתן תוצרי קנאביס רפואי בצורות מינון שאינן עישון .מבניהן ,צורת המינון הנגישה ביותר הינה
שמן במתן פומי (אוראלי) .ניתן ליצר כיום שמנים המבוססים על מרכיבי צמח הקנאביס ,בתהליך ואלידי של שמנים בעלי ריכוזי
חומרים פעילים מתוקננים והדירים ועם אורך חיי מדף ידוע .אולם גם בהינתן מוצרים מתוקננים ,המיוצרים בהתאם לסטנדרטים
של תעשיית התרופות ,קיימת בעיה של המרת המינון במטופלים אשר טופלו עד היום בעישון .על מנת לאפשר לצוות המטפל
להמיר את המינון המקובל בעישון למינון במתן פומי יש לבחון את הזמינות הביולוגית בשתי צורות המתן.
סקירה זו מרכזת את הנתונים הקיימים בספרות המדעית בנוגע לפרמקוקינטיקה של THCבעישון ובמתן פומי.
הנתונים הקיימים בספרות מועטים ו אינם תואמים בחלק מהמקרים .קיימת שונות רבה כתלות במספר רב של גורמים ,ביניהם
ריכוזי החומרים הניתנים ,מקור החומרים הפעילים ,זני הקנאביס ,מיומנות המטופלים בעישון ואמצעי מדידת ההשפעות
הפרמקולוגיות.
מעבודת סקר זו עולות מספר מסקנות:
.4
.2
.3
.1
.5
.6
יעילות ספיגת THCהניתן בעישון קנאביס ,משתנה בעשרות אחוזים בין מטופלים.
במתן פומי ,זמן התגובה להשפעה ראשונית איטי יותר לעומת בעישון ,אך משך ההשפעה ארוך במספר
שעות.
הזמינות הביולוגית של THCעולה במתן פומי משולב עם .CBD
המטבוליט ,11-OH-THCשהינו בעל ספקטרום פעילות ביולוגית הדומה לשל THCובעל פוטנטיות גבוהה,
נוצר בריכוזים גבוהים במתן פומי בעוד שבעישון רמותיו זניחות.
במתן פומי יש לקבוע זמינות ביולוגית משוקללת של THCושל .11-OH-THC
זמינותו הביולוגית המשוקללת של THCבמתן פומי גבוהה עד כדי פי 2.5מאשר בעישון.
לאור זאת ,בהתייחס ל ,THC -ניתן להסיק כי העברת מטופלים מעישון קנאביס למתן פומי מאפשרת מעקב אחר
יעילות הטיפול בצורה מושכלת ,בקרת מינונים ומתן טיפול תרופתי בצורה רוקחית .כמו כן ,רמות המינון הנדרשות במתן
פומי הן כ 05% -05% -בלבד מרמות מינון ה THC -הנדרשות בעישון.
פרמקוקינטיקה של THC
פיזור ברקמות ונפח פיזור (:)volume of distribution
,THCכמרבית התרופות הליפופיליות ,מאופיין בספיגה גבוהה ברקמות הגוף ,בעוד שבדם נמדדים ריכוזים נמוכים
בלבד .כתוצאה מכך ,נפח הפיזור של THCגבוה ומגיע עד כדי רמות של ( 10 L/kgרמות הגבוהות פי 222מנפח הפלסמה.
מספר זה הוא נפח וירטואלי המייצג את ההתפזרות הרבה של החומר ברקמות שומניות) (.)22,11
בדם ,נמצא THCבמצב קשור לחלבוני פלסמה (ליפופרוטאינים) ורק כ 42% -ממנו נקלטים בתוך תאי דם אדומים
( .)7,17תכונותיו הליפופיליות של THCמעודדות את יציאתו מכלי הדם ופיזורו ברקמות .במח ,נמדדות רמות THCהדומות
לרמות בפלסמה ( ,)33דבר המעיד על יכולתו של THCלעבור את מחסום הדם-מח ( )blood-brain barrierוהגעה לשיווי
משקל מהיר בין המח והפלסמה .לאחר מתן THCמסומן לבעלי חיים נמדדו רמות גבוהות יותר של THCברקמות שומן ,בכבד,
בלב ובריאות לעומת הרמות שנמדדו במח ובדם (.)12,14,22
זמן מחצית החיים (:)Half life time, t1/2
זמן מחצית החיים של THCבדם מתואר על ידי מודל דו מדורי .זמן מחצית החיים הראשוני הינו 3-1שעות ,בעוד
שהשלב השני ( )betaנמשך על פני 25-36שעות .פיזורו הנרחב של THCבגוף ואחסונו ברקמות שומן ,מובילים לשחרור
מתמשך של ריכוזים נמוכים של החומר מהרקמות אל הדם וכתוצאה מכך לפרוק איטי וזמן מחצית חיים ארוך (.)42,27
20 Trumpeldor St., Bet-Dagan 50200, Israel • Tel: (+972) 72-2744411 • Fax: (+972) 72-2744415 • info@panaxia,co.il
פרוק (מטבוליזם):
חלקו הארי של THCמסולק מן הגוף לאחר פרוקו למטבוליטים (רמות זניחות בלבד מסולקות כ THC -שלם שלא עבר
פרוק) .מחקרים שבוצעו בבני אדם ,בחיות מעבדה ובתרביות כבד הובילו עד כה לזיהויים של כ 32 -מטבוליטים שונים של THC
( ,)4ביניהם מעל 22מטבוליטים זוהו בשתן ובצואת בני אדם (.)43,41,13,15
פעילותם הפרמקולוגית של המטבוליטים:
בעוד שתוצר הפרוק העיקרי של ,11-nor-THC-9-COOH ,THCחסר פעילות ביולוגית ,הרי שמטבוליטים
הידרוקסילים אחרים ,כגון ( 11-OH-THCאף הוא אחד המטבוליטים העיקריים של ,)THCמאופיינים בפעילות פרמקולוגית
( .)33,31ל 11-OH-THC -ספקטרום פעילות הדומה לזה של .THCכמו כן ל 11-OH-THC -פוטנטיות פסיכואקטיבית
הגבוהה פי 3-7מזו של ,THCע"פ מדידות בשיטות שונות (.)16,26,35,24
קנאביס בעישון:
כאשר בוחנים את הנתונים בספרות לגבי ספיגת THCבעישון עולות שתי מסקנות עיקריות .האחת היא קיומה של
שונות רבה ברמת ה THC -הנספגת לדם בין מטופלים שונים .השנייה היא כי מרבית ה THC -אינו נספג כלל ואובד עוד טרם
הגעתו לגוף עד כדי אבדן של 72%מהחומר.
אומדן המינון וספיגת THCהניתן בעישון קנאביס הוא תהליך מורכב המושפע משונות רבה וחוסר אחידות במדדים
כגון :זן הקנאביס ,הרכב הסיגריה ומיומנות/סגנון המעשן ( .)25נמצא כי מידת הספיגה של קנאבינואידים בעישון קנאביס היא
פועל יוצא של עומק השאיפה ,משך הנשיפה והחזקת האוויר .אי לכך ,מעשנים מיומנים יכולים להעלות באופן משמעותי את
רמות הספיגה לעומת מעשנים שאינם מיומנים ( .)2,3בהתאם לכך נמדדו רמות של 23-27%בספיגת THCעל ידי מעשנים
מיומנים-כבדים לעומת 42-41%על ידי מעשנים שאינם מיומנים (.)1,27
מחקרים שונים אשר עקבו אחר השונות הקיימת באחוזי הספיגה של THCבעת עישון ,מצביעים על שונות גבוהה
הקיימת בין מעשנים שונים ( .)2,47,34,36ממדידות אשר בוצעו באמצעות מכונת עישון נמצא כי הספיגה שמקורה בעשן
הנשאף ( )mainstreamנעה בין .46-67%כמו כן 23-52% ,מה THC -עובר פרוק ע"י חום ( )pyrolysisו 6-52% -אובדים
בעשן הנפלט מקצה הסיגריה ( .)side stream smokeהתנהגות דומה בעישון הודגמה גם עבור הקנאבינואידים CBDוCBN -
( ,)27אולם המידע הספרותי על קנאבינואידים אלו מצומצם.
שאיפת THCלריאות מובילה לספיגה מהירה (דקות) ומרבית של THCומתבטאת בריכוזים מקסימליים בדם.
השפעות פסיכואקטיבי ות ,עליה בקצב לב והופעת דלקת הלחמית ("עין אדומה") מופיעים בפרק זמן של שניות עד דקות,
מגיעים לשיאם לאחר כ 32 -דקות ודועכים כעבור 2-3שעות (.)42,43,32
ממחקרים אשר השוו ריכוזים בדם ותחושת אופוריה לאחר מתן THCבעישון לעומת מתן תוך ורידי ,עולה כי בשתי
צורות המתן מדווחות רמות שיא בתחושת האופוריה ,בפרקי זמן דומים (כ 32 -דקות ממתן) הפוחתות לנורמה כעבור 3-1
שעות (.)7,43,23
THCבמתן פומי:
על אף שבמתן פומי זמינותו הביולוגית של THCנפגעת טרם הגעתו לאתרי הפעילות ,כאשר בוחנים את האפקט
הכללי הנובע מ THC -ומהמטבוליט הפעיל שלו ,11-OH-THC ,מתקבלת זמינות ביולוגית גבוהה באופן יחסי לרמתו בדם.
עיקר פירוק ה THC -נובע מהפרוק המטבוליטי אותו הוא עובר במנגנון של ,first pass effectהמתרחש עם הגעתו
לכבד ( .)3,7עם זאת ,ניתן לשפר את זמינותו הביולוגית ולהגיע לאחוזי ספיגה מרבים על ידי שימוש בנשאים ()vehicles
שונים ,כגון שימוש ב( glycocholate -סוכר ושוקולד) או פורמולציות בשמן ( .)47כמו כן ,נמצא כי זמינותו הביולוגית של THC
עולה במתן פומי משולב עם .CBDייתכן כי אפקט זה נובע מיכולתו של CBDלעכב את ( cytochrome P450האחראי על
קטליזת 11-OH-THCמ.)32( )THC -
20 Trumpeldor St., Bet-Dagan 50200, Israel • Tel: (+972) 72-2744411 • Fax: (+972) 72-2744415 • info@panaxia,co.il
מדידות באמצעות ,GC/MSהראו כי זמינותו הביולוגית של THCהינה 42-22%לאחר בליעת קפסולות שמן של
.)11( THCממחקרים נוספים בהם נמדדה ספיגת THCלאחר מתן פומי על ידי אכילת עוגיות שוקולד או בליעת קפסולת
מרינול (קפסולת שמן המכילה דרונבינול THC ,סינתטי) ,עולה כי רמות הספיגה נמוכות ,משתנות ממטופל למטופל ונעות בין
1-42%עבור העוגיות ( )34ו 2-41% -מדרונבינול ( .)12עם זאת ,בהשוואה לשונות המתקבלת לאחר עישון ,טווח השונות
נמוך יותר.
כמוצג בגרף ,4קצב ספיגת THCבמתן פומי איטי ביחס לקצב הספיגה בעישון :ריכוזים מרבים בדם נמדדים לרוב
כעבור 62-422דקות ולעתים גם כעבור 1-6שעות .יתר על כן ,אצל חלק מן המטופלים נצפו יותר משיא אחד ברמות הTHC -
בדם ( ,)3,43,21,34,12,13,11דבר המתאים למודל פרמקוקינטי רב מדורי.
גרף :1ריכוזיי THCבדם לאחר מתן בעישון ולאחר מתן פומי (נתונים מבוססים על מראי מקום 82ו)54 -
פעילותו הפרמקולוגית של :11-OH-THC
ריכוז המטבוליט 11-OH-THCבדם לאחר מתן פומי גבוה משמעותית מריכוזו בדם לאחר שאיפה או מתן תוך ורידי
( )5,11,3ויכול להגיע לרמות הריכוז של THCויותר (כמוצג בגרף .)4בניסוי קליני שנערך במטופלי ,HIVרמות ה THC -ו-
11-OH-THCשנמדדו בדם לאחר מתן דרונבינול במינון 2.5 mg/dayהיו 2.01 µg/Lו ,4.61 µg/L -בהתאמה (.)13
יתר על כן 11-OH-THC ,עובר את מחסום הדם-מח בקצב מהיר יותר לעומת .)42,37( THCלאחר מתן תוך ורידי
של 11-OH-THCו THCומעקב אחר קצבי לב וסימפטומים פסיכואקטיבים כגון תחושת אופוריה ,הודגם כי הפוטנטיות של
11-OH-THCמשתווה ואף עולה על זו של .)25( THCבהתאם לכך ,כאשר השוו את ריכוז ה THC -בדם ,לאחר מתן פומי
ולאחר עישון או מתן ורידי ,נמצא כי לאחר מתן פומי נדרשים ריכוזים נמוכים יותר של THCבדם על מנת לייצר תחושת אופוריה
הזהה לזו המתקבלת בעישון או מתן ורידי ( .)43ממצא זה תומך כי במתן פומי של THCמתווספת השפעתו הביולוגית של
המטבוליט 11-OH-THCלזו של .THC
20 Trumpeldor St., Bet-Dagan 50200, Israel • Tel: (+972) 72-2744411 • Fax: (+972) 72-2744415 • info@panaxia,co.il
גרף :8ריכוז THCו 11-OH-THC -בדם במתן פומי של ( 20 mg THCעל פי נתונים ממראה מקום )54
המרת מתן THCבעישון למתן פומי
העברת מטופלים מעישון קנאביס למתן פומי של THCהוא תהליך המחייב התייחסות לשונות במדדי הפוטנטיות,
זמינות ביולוגית ,ספיגה ,הגעה לריכוזי שיא בדם ומשך ההשפעה (כפי שנבחנו לעיל) .הדרך המהימנה לבצע המרה זו היא
באמצעות השוואת ערכיי ה Area Under the Curve (AUC) -בגרף האפקט כפונקציה של זמן עבור THCוהמטבוליט
הפוטנטי שלו ,11-OH-THC ,במתן פומי ובעישון .באופן מפתיע ,למיטב ידיעתנו ובדיקתנו השוואה מסוג זה חסרה בספרות
המדעית-רפואית .לפיכך ,ערכנו נרמול לינארי עבור הממצאים הפרמקוקינטים המפורסמים בספרות על מנת לקבל ערכיי AUC
התואמים למתן THCבריכוז זהה בצורות המתן השונות .אנו מודעים לכך שההתנהגות הפרמקוקינטית איננה בהכרח לינארית
ולכן נרמול זה הינו קירוב בלבד .עם זאת ,לאור השונות הרבה הקיימת במדדים השונים והעדר נתונים ממקור אחיד ,הנרמול
מאפשר הצגת ערכיי AUCבקירוב מהימן.
בגרף 3מוצגות תוצאות מנורמלות עבור השוואת ערכיי ה AUC -בדרכי מתן ובתצורות שונות של ( THCתרופות
מסחריות ,Marinol ,Savitexמיצוי קנאביס בשמן ועישון קנאביס) .נמצא כי במתן פומי הזמינות הביולוגית המשוקללת של
THCו 11-OH-THC -גבוהה עד כדי פי 2.5לעומת מתן בעישון .מן הנתונים עולה עוד כי קיימים הבדלים בערכי הAUC -
כתלות בצורת המתן הפומי .בהתאם לכך ,נמצא כי בהתזה תת-לשונית ערכי ה AUC -שנמדדו היו גבוהים לעומת הערכים
שהתקבלו לאחר התזה לפנים הלחי ,הבדל הנובע ככל הנראה מהקושי הטכני בהתזה לפנים הלחי (עדויות הנבדקים.)17 ,
בנוסף לכך ,הזמינות הביולוגית במתן פומי תת-לשוני גבוהה יותר מבמתן פומי בקפסולה ,זאת עקב ספיגה מהירה וישירה לכלי
הדם הרבים המצויים מתחת ללשון.
20 Trumpeldor St., Bet-Dagan 50200, Israel • Tel: (+972) 72-2744411 • Fax: (+972) 72-2744415 • info@panaxia,co.il
גרף :3פרמקוקינטיקה של THCבדרכי מתן שונות
.4
.2
.3
.1
.5
.6
,AUCמייצג את השטח מתחת לעקומה של גרף ריכוזי THCו 11-OH-THC -בגרף האפקט כפונקציה של זמן,
,Sativexמיצוי מצמח הקנאביס הניתן על ידי 1מתזים לפה (.)10.8 mg THC, 10 mg CBD
,Marinolמכיל דרונבינול הניתן בקפסולה ( 10 mg THCהמיוצר בצורה סינתטית).
מיצוי מצמח הקנאביס הניתן בקפסולת שמן (.)10 mg THC ,5.4 mg CBD
עישון קנאביס( 13.8 - 22 mg THC ,בממוצע .)18.2 mg
כל הנתונים מנורמלים למינון של 42.3 THCמ"ג.
מינוני קנאביס
המינון הממוצע כיום למטופלים בעלי רישיון לצריכה רפואית של קנאביס עומד על כ 32 -גר' תפרחות קנאביס לחודש.
הריכוז האופייני של THCבזני קנאביס אלו הוא 42-45%והצריכה היא על פי רב באמצעות עישון מנות של 322מ"ג .בהתאם
לכך ,מטופל ממוצע צורך כ 36 -מ"ג ( THCע"פ חישוב של )300mg*12%בכל מנת עישון ובממוצע 3.6גר' THCבחודש (ע"פ
חישוב של .)30gr*12%לכן ,בהתאם ליחס של פי 2.5בזמינות הביולוגית במתן פומי לעומת עישון נדרשת כמות של 4.11גרם
THCבכל חודש ( .)3.6/2.5במקרה של שמן בריכוז 422( 42%מ"ג THCבכל מ"ל שמן) מדובר בצריכה של 41.1מ"ל
בחודש .מינון כזה הוא שווה ערך לכ– 2.5מ"ל ביום אשר אם נחלקו ל 5 -מנות במהלך היממה ,מדובר על 2.4מ"ל (לחיצה
אחת מבקבוקון בעל מתז במינון מדוד).
סיכום
זמינותו הביולוגית של THCהנצרך בעישון גבוהה מזו הנצרכת במתן פומי .תופעה זו נובעת מפרוק THCלתוצרי
פירוק במנגנון ה first pass effect -המתרחש בכבד לאחר מתן פומי .אחד המטבוליטים העיקריים הנוצרים בתהליך הפרוק
הינו 11-OH-THCהמאופיין בפעילות פרמקולוגית הדומה לזו של .THCבניגוד למתן פומי ,בעת עישון נוצר מעט מאוד
ממטבוליט זה .עם זאת ,כשנבחנת הזמינות הביולוגית המשולבת של שני המרכיבים הפוטנטיים ( THCו,)11-OH-THC -
מתקבלת זמינות ביולוגית הגבוהה עד פי 8.4במתן פומי בהשוואה לעישון קנאביס .בהתאם לכך ,מתן פומי מאפשר נטילת
ריכוזים נמוכים יותר של THCלצורך קבלת אפקט הזהה לזה המתקבל לאחר עישון ( .)43אי לכך ,העברת מטופלים מעישון
קנאביס למתן פומי של שמני קנאביס מתוקנניי THCאפשרית ,ע"פ היחסים המוצגים לעיל ,ואף רצויה .יתר על כן ,שמנים
כאלה המיוצרים בתהליך ואלידי ובסטנדרטים של תעשיית התרופות יאפשרו לרופא להעניק טיפול תרופתי פרסונלי ,בו
המטופל מקבל מינון מתוקנן והדיר של .THCמעבר מעישון למתן פומי של שמן קנאביס יאפשר מעקב אמין אחר יעילות
הטיפול ויקדם את רפואת הקנאביס בארץ ובעולם.
20 Trumpeldor St., Bet-Dagan 50200, Israel • Tel: (+972) 72-2744411 • Fax: (+972) 72-2744415 • info@panaxia,co.il
References:
1. Agurell S, Halldin M, Lindgren JE, Ohlsson A,
Widman M, Gillespie H, Hollister L.
Pharmacokinetics and metabolism of delta-1-tetrahydrocannabinoids with emphasis on man.
Pharmacol Rev 38:21-43, 1986.
2. Agurell S, Leander K. Stability, transfer and absorption of cannabinoid constituents of cannabis
(hashish) during smoking. Acta Pharm Suec 8: 391-402, 1971.
3. Agurell S, Halldin M, Lindgren JE, et al. Pharmacokinetics and metabolism of delta 1tetrahydrocannabinol and other cannabinoids with emphasis on man. Pharmacol Rev 38:21-43,
1986.
4. Azorlosa JL, Heishman SJ, Stitzer ML, Mahaffey JM. Marijuana smoking: Effect of varying delta-9tetrahydrocannabinol content and number of puffs. J Pharmocol Exp Ther 261:114-122, 1992.
5. Brenneisen R, Egli A, Elsohly MA, et al. The effect of orally and rectally administered delta 9tetrahydrocannabinol on spasticity: a pilot study with 2 patients. Int J Clin Pharmacol Ther 34 (10):
446-52, 1996.
6. Burstein B. Biotransformation of the cannabinoids. Barnett G, Chiang CN, eds. Pharmacokinetics
and Pharmacodynamics of Psychoactive Drugs. Foster City, CA: Biomedical Publications, 1985. pp.
396-414.
7. Chiang CW, Barnett G. Marijuana effect and delta-9-tetrahydrocannabinol plasma level. Clin
Pharmacol Ther 36 (2): 234-8, 1984.
8. Frytak S, Moertel CG, Rubin J. Metabolic studies of delta-9-tetrahydrocannabinol in cancer patients.
Cancer Treat Rep 68 (12): 1427-31, 1984.
9. Garrett ER, and Hunt CA. Physicochemical properties, solubility, and protein binding of delta-9tetrahydro- cannabinol. J Pharm Sci 63(7):1056-1064, 1974.
10. Gill EW, Jones G. Brain levels of Δ1-tetrahydrocannabinol and its metabolites in mice: correlation
with behaviour, and the effect of the metabolic inhibitors SKF 525A and piperonyl butoxide.
Biochem Pharmacol 21 (16): 2237-48, 1972.
11. Goodwin RS, Gustafson RA, Barnes A, Nebro W, Moolchan ET, Huestis MA. D9Tetrahydrocannabinol,
11-Hydroxy-D9-Tetrahydrocannabinol
and
11-Nor-9-Carboxy-D9Tetrahydrocannabinol in Human Plasma after controlled oral administration of cannabinoids. Ther
Drug Monit 28(4), 2006.
12. Grotenhermen F. Pharmacokinetics and Pharmacodynamics of Cannabinoids. Clin Pharmacokinet
42 (4): 327-360, 2003.
13. Halldin MM, Andersson LKR, Widman M, Hollister LE. Further urinary metabolites of delta-1
tetrahydrocannabinol in man. Arzeimittelforsch 32:1135-1138, 1982a.
14. Halldin MM , Carlsson S, Kanter SL, Widman M, Agurell S. Urinary metabolites of delta-1tetrahydrocannabinol in man. Arzeimittelforsch 32:764-768, 1982b.
15. Halldin MM, Widman M, Bahr CV, Lindgren JE, Martin BR. Identification of in-vitro metabolites of
delta-1-tetrahydrocannabinol formed by human liver. Drug Metab and Dispos 10:297-301, 1982c.
16. Harder S, Rietbrock S. Concentration-effect relationship of delta-9-tetrahydrocannabiol and
prediction of psychotropic effects after smoking marijuana. Int J Clin Pharmacol Ther 35 (4): 155-9,
1997.
17. Harvey DJ. Metabolism and pharmacokinetics of the cannabinoids. In: Watson RR, editor.
Biochemistry and physiology of substance abuse. Vol III. Boca Raton (FL): CRC Press279-365,
1991.
18. Hollister LE, Gillespie HK, Ohlsson A, et al. Do plasma concentrations of delta 9tetrahydrocannabinol reflect the degree of intoxication? J Clin Pharmacol 21 (8-9 Suppl.): 171S-7S,
1981.
19. Huestis M. Pharmacokinetics of THC in inhaled and oral preparations. In: Nahas GG, Sutin KM,
Harvey D, Agurell S, eds. Marijuana and Medicine. Totowa New Jersey: Humana Press 105-116,
1999.
20. Hunt CA, and Jones RT. Tolerance and disposition of tetrahydrocannabinol in man. J Pharmacol
Exp Ther 215:35-44, 1980.
20 Trumpeldor St., Bet-Dagan 50200, Israel • Tel: (+972) 72-2744411 • Fax: (+972) 72-2744415 • info@panaxia,co.il
21. Karler R, Turkanis SA. Different cannabinoids exhibit different pharmacological and toxicological
properties. NIDA Res Monogr 79: 96-107, 1987.
22. Kreuz DS, Axelrod J. Delta-9-tetrahydrocannabinol: Localization in body fat. Science 179:391-393,
1973.
23. Kauert GF, Ramaekers JG, Schneider E, Moeller MR, Toennes SW. Pharmacokinetic Properties
of delta-9-Tetrahydrocannabinol in Serum and Oral Fluid. J Anal Toxic 31: 288-293, 2007.
24. Law B, Mason PA, Moffat AC, et al. Forensic aspects of the metabolism and excretion of
cannabinoids following oral ingestion of cannabis resin. J Pharm Pharmacol 36 (5): 289-94, 1984.
25. Lemberger L, Martz R, Rodda B, Forney R, Rowe H. Comparative Pharmacology of ATetrahydrocannabinol and its Metabolite, 11-OH-A9-Tetrahydrocannabinol. J Clinic. Invest. (52):
2411-2417, 1973.
26. Lemberger L, Weiss JL, Watanabe AM, et al. Delta-9-tetrahydrocannabinol. Temporal correlation of
the psychologic effects and blood levels after various routes of administration. N Engl J Med 286
(13): 685-8, 1972b.
27. Lemberger L. Nabilone, a synthetic cannabinoid of medical utility. In: Nahas GG, Sutin KM, Harvey
D, Agurell S eds. Marijuana and medicine. Totowa New Jersey: Human Press, 561-566, 1999.
28. Lindgren JE, Ohlsson A, Agurell S, et al. Clinical effects and plasma levels of delta 9tetrahydrocannabinol (delta 9-THC) in heavy and light users of cannabis. Psychopharmacology 74
(3): 208-12, 1981.
29. McGilveray IJ. Pharmacokinetics of cannabinoids. Pain Res Manage; 10 (Suppl A): 15A-22A, 2005
30. Nadulski T, Pragst F, Weinberg G, Roser P, Schnelle M, Fronk EM, Stadelmann AM. Randomized,
Double-Blind, Placebo-Controlled Study About the Effects of Cannabidiol (CBD) on the
Pharmacokinetics of D9-Tetrahydrocannabinol (THC) After Oral Application of THC Verses
Standardized Cannabis Extract. Ther Drug Monit 27:799–810, 2005.
31. Ohlsson. A, Lindgren JE, Wahlen A, Agurell S, Hollister LE, Gillespie HK. Plasma delta-9tetrahydrocannabinol concentrations and clinical effects after oral and intravenous administration
and smoking. Clinic Pharmacology 28:409-416, 1980.
32. Ohlsson A, Lindgren, JE, Wahlen A, Agurell S, Hollister LE, Gillespie HK. Single-dose kinetics
ofdeuterium-labelled delta-1-tetrahydrocannabinol in heavy and light users. Biomedical Mass
Spectrometry 9:6-10, 1982.
33. Perez-Reyes M, Timmons MS, Lipton MA, Christensen HD, Davis KH, Wall ME. A comparison of
the pharmacological activity of delta-9-tetrahydrocannabinol and its monohydroxylated metabolites
in man. Experientia 29:1009-1010, 1973.
34. Perez-Reyes M. Pharmacodynamics of certain drugs of abuse. In: Barnett, G., and Chiang, C.N.,
eds. Pharmacokinetics and Pharmacodynamics of Psychoactive Drugs. Foster City, CA: Biomedical
Publications, 1985. pp. 287-310.
35. Perez-Reyes M, Timmons M, Lipton M, et al. Intravenous injection in man of delta-9tetrahydrocannabinol and 11-OH-delta- 9-tetrahydrocannabinol. Science 177 (49): 633-5, 1972.
36. Perez-Reyes M. Marijuana smoking: Factors that influence the bio-availability of
tetrahydrocannabinol. NIDA Res Monogr 99:42-62, 1990.
37. Perez-Reyes M, Simmons J, Brine D, et al. Rate of penetration of Δ9-tetrahydrocannabinol and 11hydroxy-Δ9-tetrahydrocannabinol to the brain of mice. In: Nahas GG, editor. Marihuana: chemistry,
biochemistry, and cellular effects. New York: Springer179-185, 1976.
38. Rapaka, R.; Makriyannis, A;NIDA Res Monogr. 1987;79.
39. Robbe HWJ. Influence of marijuana on driving. Maastricht: Institute for Human
Psychopharmacology, University of Limburg, 1994.
40. Ryrfeldt, A.; Ramsay, C.H.; Nilsson, I.M.; Widman, M.; and Agurell, S. Whole-body autoradiography
of delta-1-tetrahydrocannabinol and delta-8-tetrahydrocannabinol in mouse. Acta Pharm Suec
10:13-28, 1973.
41. Siemens Doyle OL, Pryor GT. Determination of the disposition of 14C-delta-9-tetrahydrocannabinol
and 3H-delta-9-tetrahydrocannabinol. Life Sciences 24:1261-1274, 1979.
20 Trumpeldor St., Bet-Dagan 50200, Israel • Tel: (+972) 72-2744411 • Fax: (+972) 72-2744415 • info@panaxia,co.il
42. Sporkert F, Pragst F, Ploner CJ, et al. Pharmacokinetic investigation of delta-9tetrahydrocannabinol and its metabolites after single administration of 10mg Marinol in attendance
of a psychiatric study with 17 volunteers. Poster at the 39th Annual International Meeting,
International Association of Forensic Toxicologists; Aug 26-30; Prague, Czech Republic, 2001.
43. Timpone JG, Wright DJ, Li N, et al. The safety and pharmacokinetics of single-agent and
combination therapy with megestrol acetate and dronabinol for the treatment of HIV wasting
syndrome. AIDS Res Hum Retroviruses 1997; 13 (4): 305-15.
44. Wall ME, Sadler BM, Brine D, et al. Metabolism, disposition, and kinetics of delta-9tetrahydrocannabinol in men and women. Clin Pharmacol Ther 34:352–363, 1983
45. Wall ME, Perez-Reyes M. The metabolism of delta-9-tetrahydrocannabinol and related
cannabinoids in man. J Clin Pharmacol 21:178-189, 1981.
46. Wall ME, Brine DR, Perez-Reyes M. Metabolism of cannabinoids in man. In: Braude MC, Szara S,
editors. Pharmacology of marihuana. New York: Raven Press 93-113, 1976.
47. Widman M, Agurell S, Ehrnebo M, Jones G. Binding of (+)-and (-)-delta-1-tetrahydrocannabinols
and (-)-7-hydroxydelta-1- tetrahydrocannabinol to blood cells and plasma proteins in man. Journal
of Pharmacy and Pharmacology 26(11):914-916, 1974.
48. Widman M, Halldin MM, Agurell S. Metabolism of delta-1-tetrahydrocannabinol in man. In: Barnett
G, Chiang CN, eds. Pharmacokinetics and Pharmacodynamics of Psychoactive Drugs. Foster City,
CA: Biomedical Publications, 1985. pp. 415-426.
49. Sativex® product monograph: http://www.ukcia.org/research/SativexMonograph.pdf
50. Marinol® product monograph :
http://www.abbott.ca/static/cms_workspace/en_CA/content/document/MARINOL-PM-01JAN11.pdf
20 Trumpeldor St., Bet-Dagan 50200, Israel • Tel: (+972) 72-2744411 • Fax: (+972) 72-2744415 • info@panaxia,co.il